
amit én arról, hogy ossza meg veled egy útmutató orvosi eszköz szabályozási osztályozás.
ebben az útmutatóban lépésről-lépésre meghatározom, hogy az orvosi eszközt az amerikai FDA, az Európai Bizottság és a Health Canada hogyan osztályozza. A szabályozási termék osztályozásának alapvető megértése felbecsülhetetlen értékű lesz az új termékek forgalomba hozatalára irányuló erőfeszítéseihez.,
szabályozási osztályozás 101
az orvostechnikai eszközre vonatkozó szabályok attól függnek, hogy a terméket a szabályozó ügynökségek hogyan osztályozzák. Minden szabályozó ügynökség számos különböző osztályozást határozott meg az orvostechnikai eszközök számára.
az osztályozások nagyrészt vagy általános szabályként kapcsolódnak a terméktípus észlelt kockázatához.
a nemzetközileg értékesítő orvostechnikai eszközgyártóknak meg kell ismerkedniük e piacok vonatkozó előírásaival. Ezt könnyebb mondani, mint megtenni, és kihívást jelenthet a legtöbb gyártó számára., Az USA-nak megvannak a maga szabályai, míg Kanada ragaszkodik egy másikhoz, Európa pedig még mindig.
szerencsére sok párhuzam van a nemzetközi orvostechnikai eszközök előírásai és szabványai között. Ez az útmutató célja, hogy mutassa meg, hogyan kell osztályozni a készüléket a különböző piacokon szerte a világon.

miért számít a szabályozási osztályozás?
az orvosi eszköz besorolásának ismerete a következő okok miatt fontos:
- a termék osztályozása meghatározza, hogy mit kell tennie, mielőtt eladná a terméket.,
- a termék osztályozása segít a követelmények meghatározásában a termékfejlesztési szakaszban, különös tekintettel a tervezési vezérlőkre.
- a Termékosztályozás fontos eleme annak meghatározásában, hogy mennyibe fog kerülni a készülék forgalomba hozatala, és ad néhány ötletet arról, hogy mennyi ideig tart.
emiatt egy kis útmutatást fogok adni neked, hogy jobban megértsd, mit kell csinálni és hogyan kell csinálni.,
Megjegyzés: Az általam közölt információ célja, hogy segítse Önt az orvostechnikai eszközök szabályozási osztályozásában, valamint az orvosi eszközhöz szükséges ismeretek oktatásában.
a következő tartalom nem átfogó útmutató a szabályozási beadványokhoz, mégis meg kell adnia néhány alapvető útmutatást és irányt a piacra vezető út meghatározásához.
ragaszkodom a “big 3” – hoz, amelyet tudnia kell az orvostechnikai eszközök osztályozásáról:
- USA., Élelmiszer & gyógyszeradagolás, eszközök központja & radiológiai Egészség (FDA CDRH)
- Európai Bizottság
- Health Canada
orvosi eszköz szabályozási osztályozása az Egyesült Államokban

U. S. Food & Drug Administration (FDA)
az Egyesült Államokban az orvosi eszközöket az élelmiszer szabályozza & Drug Administration, vagy FDA., Az FDA specifikus ága a & radiológiai Egészség (CDRH) központja.
a CDRH küldetése a közegészségügy védelme és előmozdítása. Más szavakkal, győződjön meg arról, hogy az orvosi eszközök biztonságosak. Az Egyesült Államokban az orvostechnikai eszközök I., II. vagy III. osztályúak.az FDA CDRH osztályozása elsősorban az orvosi eszköz által jelentett kockázatokon alapul.
Az I. osztályú orvostechnikai eszközöket általában alacsony kockázatnak tekintik, a III.osztályú orvostechnikai eszközöket pedig a legmagasabb kockázatnak tekintik. A szükséges ellenőrzések típusai a termék besorolásától függenek.,
A besorolás közvetlenül kapcsolódik a rendeltetésszerű használathoz és a használati utasításokhoz. A különbség ezek között a kifejezések egy kicsit zavaró.
- a rendeltetésszerű használat az orvostechnikai eszköz általános célja vagy funkciója(amit az orvostechnikai eszköz” állít”).
- a használati utasítás leírja azt a betegséget vagy állapotot, amelyet az orvostechnikai eszköz diagnosztizálni, kezelni, megelőzni, gyógyítani vagy enyhíteni fog, beleértve a cél betegpopuláció leírását is.
ezt tartsa szem előtt., Az orvostechnikai eszköz rendeltetésszerű használata és használati utasításai kifejezik, hogy miért született ez az ötlet egy új orvostechnikai eszközre.
hogyan lehet megtalálni az orvostechnikai eszközre vonatkozó FDA-előírásokat
miután meghatározta a rendeltetésszerű használatot és a használati utasításokat, most meg kell találnia a lehetséges rendeleteket és termékkódokat. A termék FDA-n keresztüli szabályozási osztályozásának nyomon követése egy kis időt és kitartást igényel.,
anélkül, hogy túl sok részletet untatna, az FDA számos általános kategóriát hozott létre a CFR 21. címének orvosi specialitása alapján-Élelmiszer és gyógyszerek: 862-892. rész.
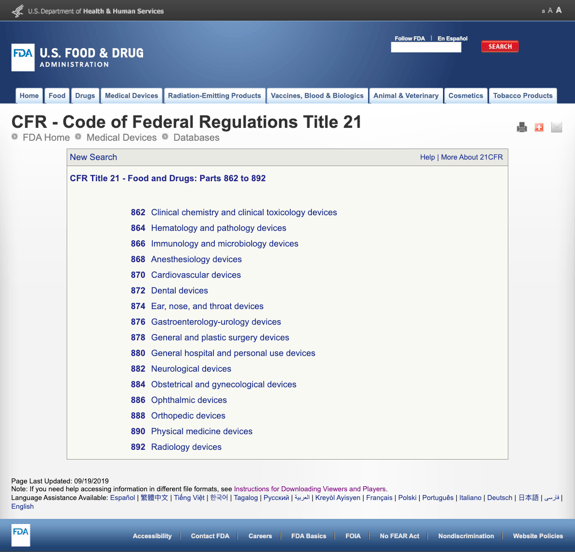
amikor megtalálja a lehetséges kategóriákat, majd rákattint az FDA szabályozási számára, a lehetőségek listája hirtelen végtelennek tűnik. Itt van egy részleges kilátás a lehetőségek rész 870 kardiovaszkuláris eszközök:

Ez lehet frusztráló, elsöprő.,
ha olyan szabályozást talál, amely lehetséges illeszkedésnek tűnik, kattintson a linkre, és további részleteket kaphat a meghatározáshoz.
például, ha azt hiszem, hogy a készülék megfelel a “870.1250 Percutan katéter,” rákattintok a linkre, majd ezt az információt:

A megadott adatokat adj egy kis ötlet, ha a rendeltetés, valamint a javallatok align ez a sajátos rendelet. Felfedezem az FDA eszközosztályozását is.,
ebben a példában megtudom, hogy a termékem egy II.osztályú orvostechnikai eszköz (teljesítmény szabványok), ami azt jelenti, hogy 510(k) – t kell benyújtanom az FDA-nak a piaci engedély megszerzése előtt. Megosztom többet típusú FDA beadványok tovább ebben az útmutatóban.
Next-keresse meg a készülékére vonatkozó termékkódokat
keresse meg az orvostechnikai eszközre vonatkozó előírásokat, és az osztályozás az első rész. Most meg kell találnia az alkalmazandó termékkódokat. Így:
LÉPJEN az FDA Termékosztályozási adatbázisába, majd írja be a talált szabályozási számot., Ha egynél több lehetőséget talál, akkor mindegyikre meg kell ismételnie ezt a folyamatot.
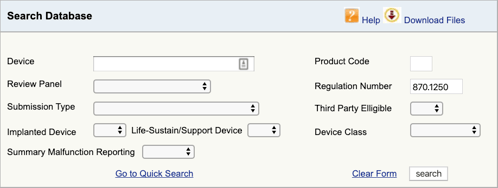
amikor a” Keresés ” gombra kattint, megkapja a lehetséges termékkódok listáját.
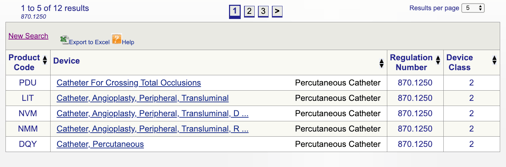
ezután áttekintheti az egyes kódokat, hogy meghatározza a termék legjobb lehetőségét az egyes kódokra kattintva.
az alkalmazandó szabályozás és Termékkód ismerete (a fent leírtak szerint) szükséges ahhoz, hogy meghatározza az orvostechnikai eszköz besorolását., Miután ezt az információt, akkor most képes lesz meghatározni a” path”, hogy a termék regisztrált FDA.,
FDA határozza három szabályozó minden orvosi eszköz osztály:
- Osztályú orvostechnikai eszköz (alacsony-közepes kockázat): Általános Ellenőrzések
- Class II orvostechnikai eszköz (közepes vagy magas kockázatú): Általános ellenőrzéssel, valamint a Speciális Vezérlők
- III. Osztályú orvosi eszköz (magas kockázatú): Általános Ellenőrzések, valamint Premarket Jóváhagyása (PMA)
Hadd foglaljam össze, hogy ez:
Ha találsz a termék “mentesített”, akkor csak általános ellenőrzések alkalmazni, illetve nem formális FDA benyújtása szükséges. Önnek azonban regisztrálnia kell a létesítményt az FDA-nál, majd fel kell sorolnia a terméket.,
Ha úgy találja, hogy a termék speciális ellenőrzéseket igényel, ez azt jelenti, hogy 510(k) benyújtást kell készítenie az FDA-nak, és engedélyt kell kapnia a piacra lépés előtt. Ezt követően regisztrálnia kell a létesítményt, és fel kell sorolnia a terméket.
Ha úgy találja, hogy a termék premarket jóváhagyást igényel, ez azt jelenti, hogy be kell tartania az FDA PMA folyamatot, hogy jóváhagyást kapjon a piacra lépés előtt.,
Orvostechnikai Eszköz Besorolás Európában

Európai Bizottság
A szabályzat egy orvosi eszköz az Európai Unió (EU) által megállapított-az Orvostechnikai eszközökről szóló Irányelvek által az Európai Bizottság (eb).
az európai piacra vezető út a CE-jelölés megszerzése.
ahhoz, hogy megtudja, mi szükséges az orvostechnikai eszközt jelölő CE megszerzéséhez, először meg kell határoznia az orvostechnikai eszköz EU-besorolását., Az Európai Unió orvostechnikai eszközökről szóló rendelete (EU MDR) tartalmazza az eszközosztály meghatározásához szükséges információkat.
az EU MDR 2017/745 módosítja a 2001/83/EK irányelvet, a 178/2002/EK rendeletet és az 1223/2009/EK rendeletet, valamint hatályon kívül helyezi a 90/385 / EGK és a 93/42 / EGK tanácsi irányelvet. Az EU MDR 2020 májusától az orvostechnikai eszközök kötelező szabályozásává válik.
meg kell határoznia, hogy az orvostechnikai eszköz:
- non-invazív
- minden olyan eszköz, amely nem hatol be a testbe egy nyíláson vagy a test felületén keresztül., Ezek az eszközök jellemzően I. osztályúak; azonban bizonyos szabályok és kivételek alkalmazandók, amelyek II. vagy magasabb Osztályúvá tehetik őket.
- invazív
- minden olyan eszköz, amely egészben vagy részben behatol a test belsejébe, akár a test nyílásán keresztül, akár a test felületén keresztül.
- Active
- bármely olyan eszköz, amelynek működése az emberi test által e célra létrehozott energiaforrástól vagy a gravitációtól eltérő energiaforrástól függ, és amely az energia sűrűségének megváltoztatásával vagy átalakításával működik.,
az új orvostechnikai eszközökről szóló rendelet VIII.mellékletében meghatározott szabályok vonatkoznak az egyes általános kategóriákra. Ezek a kategóriák a használat időtartamával párosulva meglehetősen egyszerűvé teszik a besorolás meghatározását.
például egy 60 perc alatt folyamatos használatban lévő eszközt átmeneti időtartamnak, 60 perctől 30 napig rövid távúnak, 30 napnál hosszabbnak kell tekinteni.,
ezt szem előtt tartva, hogy meghatározza az EU osztályozása a készülék, tudjuk használni a perkután katéter példa korábban használt ebben az útmutatóban FDA besorolás.
tegyük fel, hogy az orvosi eszközöm az “invazív” kategóriába illeszkedik; ez szűkíti a keresést az 5., 6., 7. és 8. szabályokra.
ezután tovább szűkíthetem a szabályokat, mivel tudom, hogy az orvostechnikai eszköz rövid távú, mert 24 óránál hosszabb ideig, kevesebb, mint 30 napig használják.
innen Meg tudom határozni, hogy a 7.szabály a leginkább alkalmazható a készülék besorolására.,

forrás: EU MDR 2017/ 745 VIII.
az európai piacra vezető út meghatározása
Az Európai Unió hasonló termékosztályozási rendszerrel rendelkezik, mint az Egyesült Államok.,:
- I. osztály
- IIA osztály
- IIB osztály
- III. osztály
minden esetben az Európai Unióban értékesítendő orvostechnikai eszközök esetében a műszaki dokumentáció szükséges lépés a CE-jelölés megszerzésének folyamatában. Az EU-ban minden orvostechnikai eszközosztálynak szüksége van egy bejelentett szervezettel való együttműködésre, kivéve azokat, amelyek I. osztályba tartoznak, és amelyek tanúsíthatók.
A vállalatoknak egy meghatalmazott képviselővel is együtt kell működniük, hogy gondoskodjanak a termék regisztrációjáról Európában., A 11. cikk az EK Meghatalmazott képviselőivel kapcsolatos legfontosabb kérdések segíthetnek abban, hogy további felvilágosítást nyújtsanak arról, hogyan lehet elérni az orvostechnikai eszközök osztályozását Európában.
orvostechnikai eszközök besorolása Kanadában

Health Canada
az orvostechnikai eszközök Szabályzatát Kanadában a kanadai kormány állapítja meg és az egészségügyi Kanada szabályozza.
Mint az USA, EU, hogy eladja a Kanadai piacon, először meg kell határoznia, hogy az orvostechnikai eszköz besorolás alatt Kanada rendelet.,
Hasonló a vázolt követelmények az EU MDR, Egészségügyi Kanada rendelkezik egy meglehetősen egyszerű, s könnyen követhető Útmutatást a Kockázat alapú Osztályozási Rendszer a Nem-In Vitro Diagnosztikai Eszközök az orvosi eszközök gyártóira vonatkozó használni, ha eladja a piacon.,
A Health Canada a nem in vitro diagnosztikai orvostechnikai eszközök négy csoportját határozza meg:
- invazív eszközök (szabályok 1-3)
- nem invazív eszközök (szabályok 4 – 7)
- aktív eszközök (szabályok 8-12)
- speciális szabályok (szabályok 13 – 16)
mindegyik széles kategóriára vonatkoznak szabályok. Ezeket a szabályokat kell követnie a gyártóknak annak érdekében, hogy meghatározzák eszközük kockázati besorolását.
a perkután katéter példáját még egyszer használom egy ilyen eszköz Kanadában történő forgalmazása esetén., 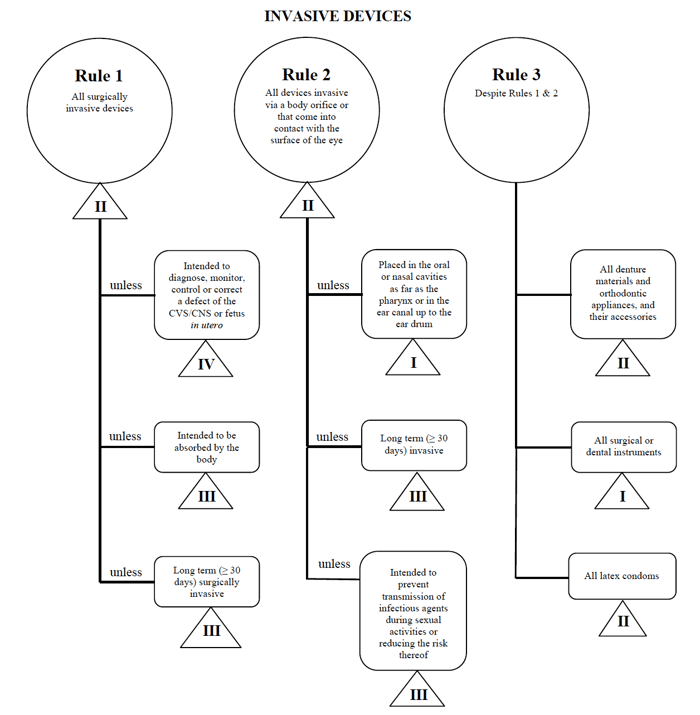
Forrás: Útmutató a Kockázati alapú Osztályozási Rendszer a Nem-In Vitro Diagnosztikai Eszközök
azt döntse el az orvosi eszköz illeszkedik az “invazív” kategória, szűkül a keresést Szabályok 1, 2, 3.
az opciók áttekintése után megállapítom, hogy az 1.szabály érvényes.
a tervezett felhasználásom alapján az orvosi eszközöm Kanadában II. osztálynak számít.,
meghatározása az utat a piacra Kanadában
négy szintje orvostechnikai eszköz osztályozás Kanadában:
- I. osztály
- II. osztály
- III. osztály
- IV. osztály
előtt megy a piacra Kanadában, akkor először alkalmazni kell egy orvosi eszköz engedély. Az I. osztályú orvostechnikai eszközök nem igényelnek engedélyt. A gyártók hivatkozhatnak a Health Canada útmutató dokumentumra, amely végigvezeti Önt ezen a folyamaton.,
A III. és IV. osztályú orvostechnikai eszközök gyártói a kanadai piacra való belépéshez premarket-kérelmet nyújthatnak be, akár ToC, akár Health Canada formátumban.
meg kell szereznie az ISO 13485 tanúsítványt az MDSAP segítségével.
Update to Health Canada Regulations: MDSAP
2019 januárjától minden olyan orvostechnikai eszközgyártónak, amely II.osztályú orvostechnikai eszközöket értékesít, és a kanadai piacon magasabb, részt kell vennie az orvostechnikai eszközök egységes ellenőrzési programjában (MDSAP).,
ezeknek a gyártóknak át kell esniük a minőségirányítási rendszerük (QMS) teljes körű ellenőrzésén a kanadai programon keresztül. Jelenleg 6 régió van szerte a világon, amelyek részt vesznek az MDSAP-ban, beleértve Kanadát, az Egyesült Államokat, Japánt, Brazíliát és Ausztráliát.
A Health Canada által a programban való részvételhez szükséges gyártók mellett az MDSAP-ban való részvétel opcionális a gyártók számára.,
szerezni MDSAP tanúsító, egészségügyi készülék gyártók kell töltenie az alábbi három lépésből áll:
- Alkalmazás felülvizsgálat
- Off-site dokumentáció ellenőrzés
- A helyszíni ellenőrzés
a Készülék döntéshozók eladási Kanadába lesz kitéve éves értékelés, a megújító audit minden harmadik évben. Az orvostechnikai eszközök egységes ellenőrzési programjának való megfelelés az orvostechnikai eszközök minőségirányítási rendszereiről szóló ISO 13485 szabvány iránymutatásainak teljesítésén alapul.,
javasoljuk, hogy a termék, a minőség és a szabályozó csapatok képzését a vonatkozó MDSAP követelményekben az alkalmazás egyszerűsítése érdekében.
ingyenes gap értékelési eszközünk az MDSAP és az ISO 13485 szabvány számára segít az eszközgyártóknak az ISO szabvány QMS-irányelveinek felmérésében az egészségügyi Kanadai könyvvizsgáló szervezetek (Ao) és a programban részt vevő egyéb régiók követelményei mellett., 
Utolsó Gondolatai
most van az információ, a források meg kell határoznia, hogy az orvostechnikai eszköz besorolása, valamint út-piac a három legnagyobb piac a világon.
a készülék besorolásától függetlenül elengedhetetlen, hogy kövesse az egyes piacokon alkalmazandó szabályozási irányelveket. Találkozó megfelelés kulcsfontosságú szempont a minőségirányítás, amely végül dönt a sorsa a készülék, illetve a vállalat egészére.,
a Greenlight Guru-nál értékeljük az orvosi eszközminőség-kezelés (MDQMS) fontosságát. MDQMS szoftverünk az egyetlen megoldás a világon, amelyet kifejezetten orvostechnikai eszközökhöz terveztek. Ez igazodik a legújabb iparági szabvány bevált gyakorlatok kezelésére termék tervezési ellenőrzések és a kockázat, valamint a változás ellenőrzési tevékenységek és egyéb minőségi események, amely teljes nyomon követhetőség egész életciklusa alatt az orvosi eszköz.
tervezésvezérlő megoldást keres, amely segít a biztonságosabb orvostechnikai eszközök gyorsabb forgalomba hozatalában, kevesebb kockázattal?, Kattintson ide, hogy egy gyors túra Greenlight Guru orvosi eszköz QMS szoftver →