aangemaakt door Makthebrainhappy.
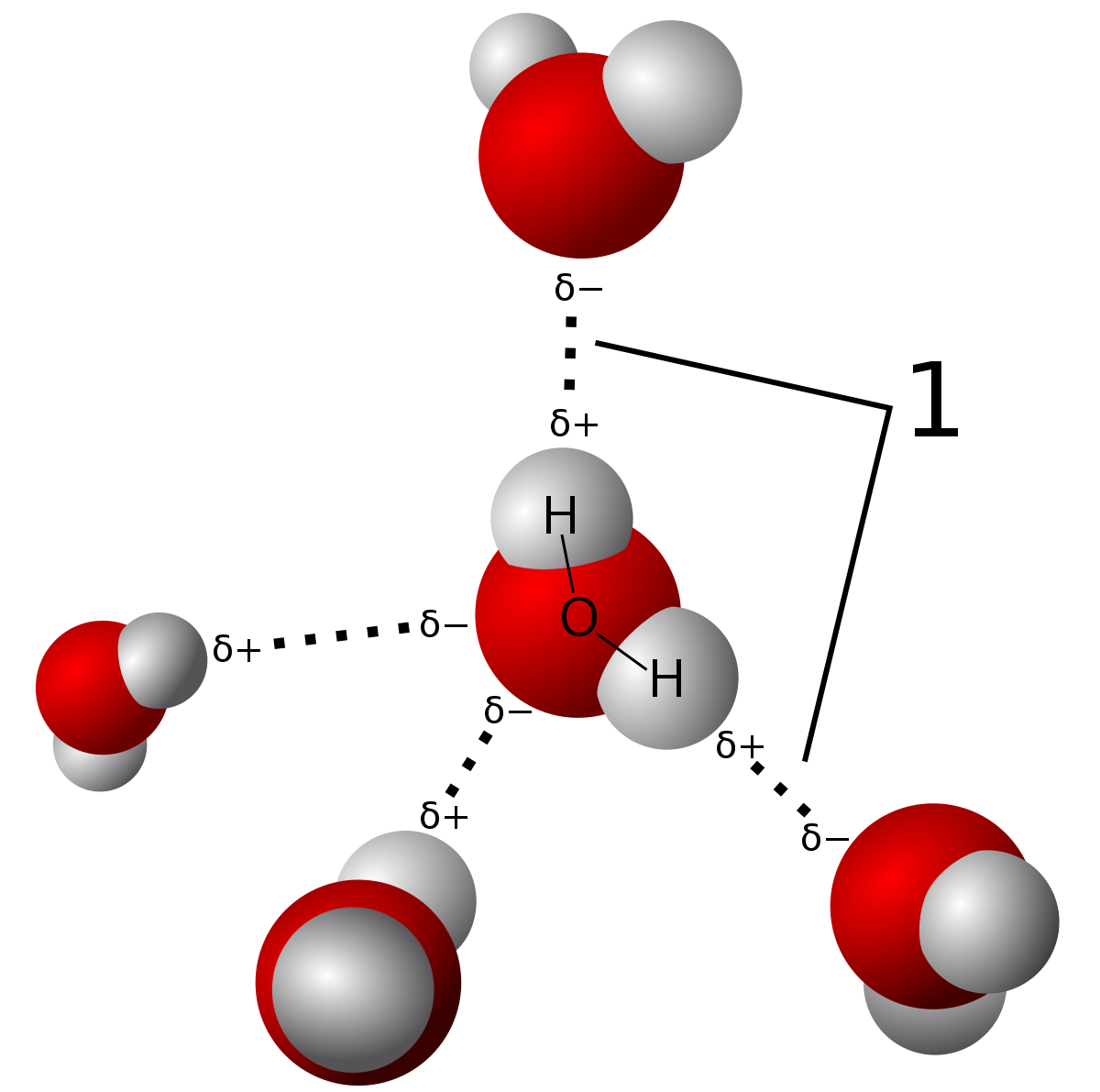
waterstofbindingen zijn een soort intermoleculaire kracht waarbij het elektronegativiteitsverschil in het zuurstofatoom ervoor zorgt dat er een partieel permanent dipool ontstaat tussen de waterstof-en zuurstofatomen (zie de stippellijnen). De bindingen in het watermolecuul zelf zijn covalente bindingen. U kunt leren over het verschil in deze post., Bron
door de sterkte van deze waterstofbindingen heeft water een relatief hoog smelt-en kookpunt, hoewel ze niet zo hoog zijn als netwerkcovalente vaste stoffen. Die worden gebonden door intramoleculaire krachten die het feitelijke delen van elektronen Versus gedeeltelijke dipoolkrachten in waterstofbindingen impliceren. Er zijn slechts drie soorten bindingen die waterstof kunnen binden. Dit zijn N-H, O-H, en F-H bindingen toe te schrijven aan de grote elektronegativity verschillen tussen de molecules.,
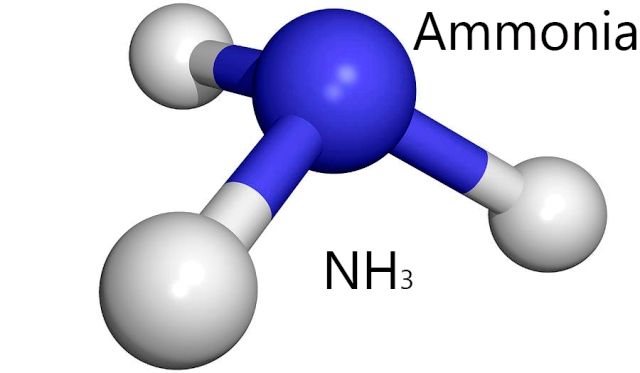
NH3 is een ander molecuul dat waterstofbindingen creëert als H2O. bron
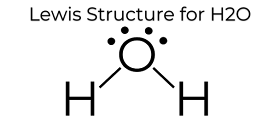
welke andere eigenschappen heeft water?water is een van de enige elementen die in alle drie de staten (vast, vloeibaar en gasvormig) van nature op aarde voorkomen. Waterstofbinding veroorzaakt een kristallijne structuur waardoor het minder dicht is dan vloeibaar water. Daarom drijft ijs in de oceanen. Water heeft ook een hoge oppervlaktespanning en hechting., Cohesie en hechting zijn essentieel voor planten die deze processen manipuleren om water van de wortels naar de bladeren te verplaatsen om de groei van de plant te ondersteunen. Dit alles wordt veroorzaakt door de eenvoudige structuur van H2O, vertegenwoordigd door het Lewis Dot Diagram hierboven.

watermoleculen in alle drie de materietoestanden. Bron