E en Z notatie voor alkenen
inhoudsopgave
- wanneer gebruiken we cis– en transnotatie In ringen?
- cis– en trans-isomerisme in alkenen
- kijk uit voor dubbelzinnige Namen wanneer geometrisch isomerisme mogelijk is!,
- cis– en trans-isomerisme in cyclische alkenen
- wanneer ” cis “- en “trans ‘” faalt: E en Z notatie
- E en Z notatie voor alkenen
- Breaking Ties: the Method of Dots
- conclusie: E en Z notatie voor alkenen
- opmerkingen
- Quiz uzelf!
Dit artikel werd samen met Matt Pierce van Organic Chemistry Solutions geschreven. Vraag Matt over het plannen van een online tutoring sessie hier.,
Quick Review: cis-en trans – isomerisme (“Geometrisch isomerisme”) in ringen
eerder in onze MOC-Serie over cycloalkanen zagen we dat een belangrijk kenmerk van kleine ringen is dat ze niet” binnenstebuiten ” kunnen worden gedraaid zonder bindingen te breken.
een van de belangrijkste gevolgen hiervan is dat het kan leiden tot het bestaan van stereoisomeren – moleculen die dezelfde moleculaire formule en dezelfde connectiviteit hebben, maar een andere rangschikking van atomen in de ruimte hebben.
deze twee versies van 1,2 dichloorcyclopentaan (hieronder) zijn een voorbeeld., Ze hebben dezelfde connectiviteit-beide zijn 1,2-dichloorcyclopentaan-maar hebben verschillende arrangementen van hun atomen in de ruimte. De chlorines bevinden zich aan dezelfde kant van de ring in de linker isomeer (beide “wiggen”, die uit de pagina komen) en aan de tegenovergestelde kanten (een geklemd, een gestreept) aan de rechter isomeer.
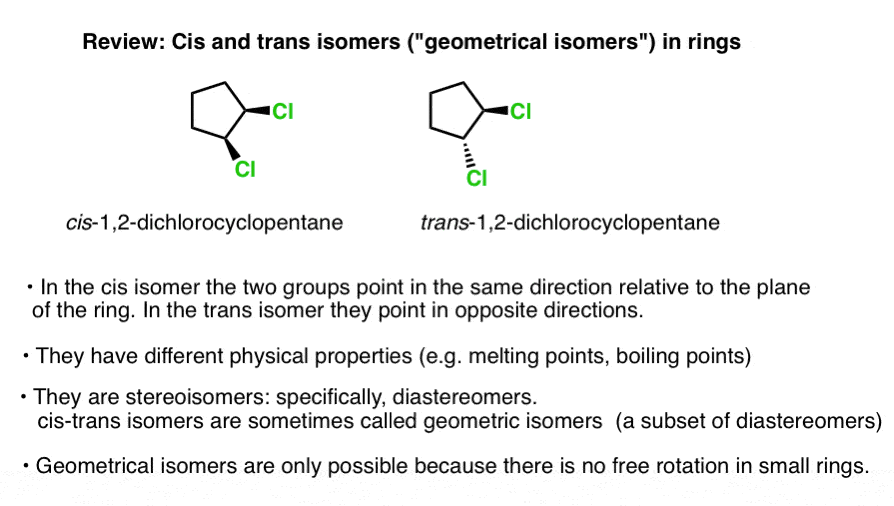
Deze twee moleculen kunnen niet onderling worden geconverteerd door rotatie van de C-C Binding zonder de ring te breken (gebruik een ModelKit en probeer het, als je wilt). Het zijn dus isomeren.,
moleculen met dezelfde connectiviteit maar een andere rangschikking in de ruimte worden stereoisomeren genoemd.
specifiek is de relatie tussen de twee bovengenoemde moleculen die van diastereomeren: stereoisomeren die geen spiegelbeelden van elkaar zijn.
deze twee moleculen hebben verschillende fysische eigenschappen – verschillende kookpunten, smeltpunten, reactiviteiten, spectrale kenmerken, enzovoort.
1. Wanneer gebruiken we cis – en trans-notatie in ringen?,
we gebruiken de termen cis – en trans-om de relatieve configuratie van twee groepen ten opzichte van elkaar aan te geven in situaties waar er een beperkte rotatie is.
in de nomenclatuur wordt” cis ” gebruikt om de isomeer te onderscheiden waarbij twee identieke groepen (bijvoorbeeld de twee chlorinen in 1,2-dichloorcyclopentaan) in dezelfde richting wijzen ten opzichte van het vlak van de ring, en trans om de isomeer te onderscheiden waar zij in tegengestelde richtingen wijzen.
een veel voorkomende naam voor deze zogenaamde “cis-trans”-isomeren is “geometrische isomeren”.,
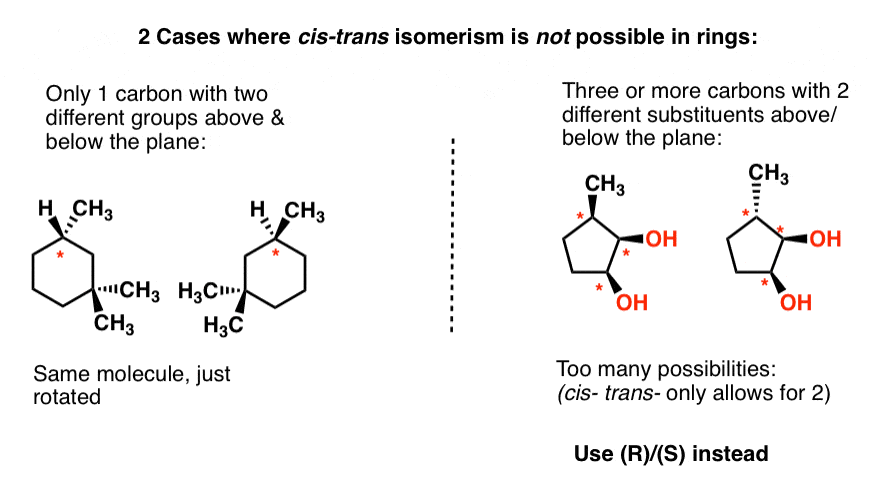
om voor cis – trans – isomerism te bestaan in ringen, we moeten twee voorwaarden:
- twee (slechts twee) koolstofatomen, ieder met niet-identieke substituenten boven en onder de ring
- de twee koolstofatomen hebben ten minste een van de substituenten in common
In 1,2-dichlorocyclopentane zagen we dat de C-1 en C-2 hadden elk niet-identieke substituenten (H en Cl) boven en onder de ring, en zij hadden elk minstens één substituent in common (in feite hebben ze twee substituenten gemeen: H en Cl ).
Hier is een ander voorbeeld: cis – en trans– 1-ethyl-2-methylcyclobutaan., Merk op dat ze elk twee koolstofatomen hebben die elk niet-identieke substituenten dragen boven en onder de ring (H en CH3; H en CH2CH3). Ze hebben ook ten minste één substituent gemeen (H). We kunnen dus verwijzen naar cis-1-ethyl-2-methylcyclohexaan als de isomeer waar de twee waterstofstoffen in dezelfde richting wijzen, en trans waar ze in tegengestelde richtingen wijzen.
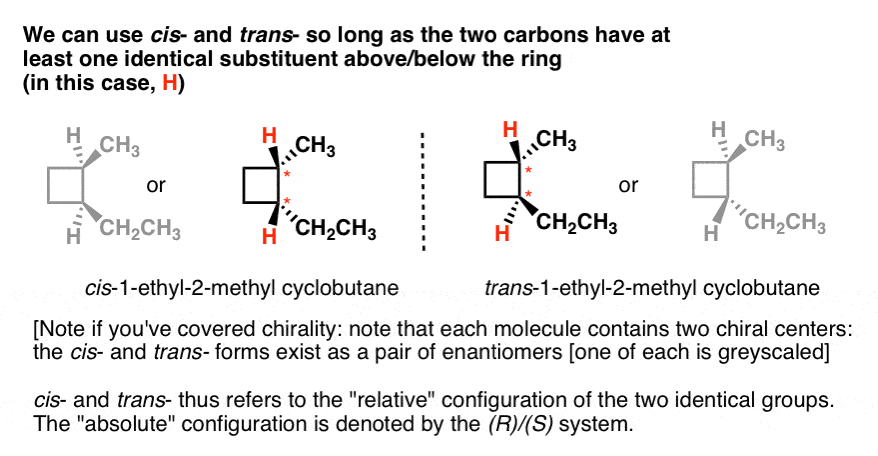
Als u chiraliteit hebt behandeld, kunt u ook een interessant feit opmerken: er zijn twee manieren om elk van de cis – en trans– isomeren te tekenen, en ze kunnen niet op elkaar worden gelegd., Dit zijn enantiomeren, trouwens.
dus cis – en trans-specificeert niet welke enantiomeer (het kan op beide worden toegepast). Het beschrijft alleen de relatieve configuratie van de twee groepen (H in dit geval). Als we een bepaalde enantiomeer willen specificeren, moeten we het Cahn-Ingold-Prelog (CIP) systeem gebruiken om r en s configuraties toe te wijzen, die ons van de “absolute” configuratie voorziet. In dat geval zijn cis– en trans – overbodig.
omdat cis– en trans– relatief zijn, werkt het niet als de twee koolstofatomen geen gemeenschappelijke substituent delen. In dat geval moet je ook (R)/(S) gebruiken .,
Het duurt hier te lang om door ringen te gaan, dus laten we 2 Voorbeelden illustreren waar “cis” en trans” niet in ringen werken en het daar laten.
2. cis – en trans-isomerisme (Geometrisch isomerisme) in alkenen
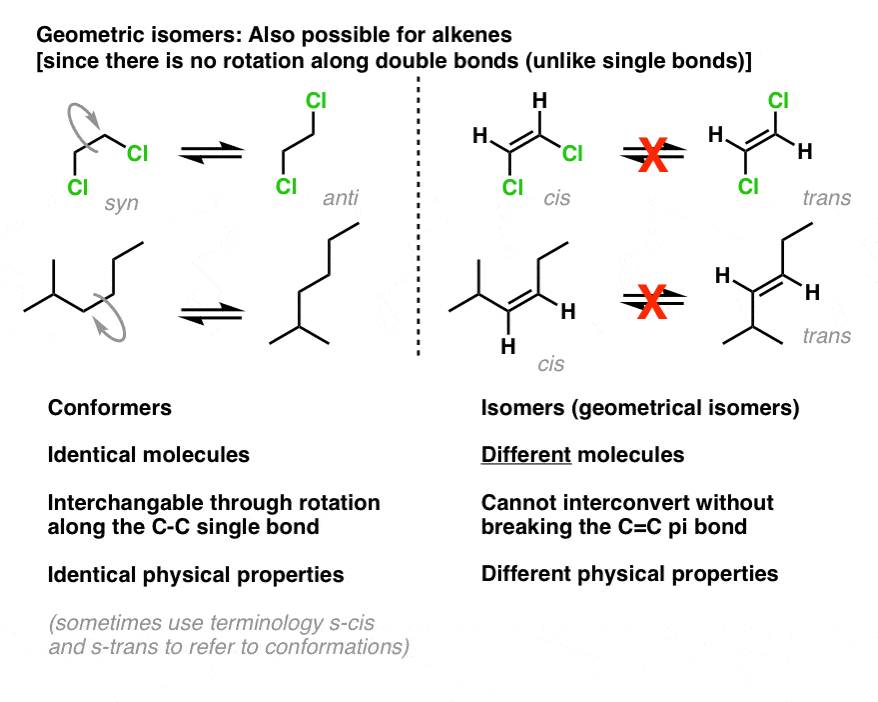
cis-trans isomerisme is ook mogelijk voor alkenen. Net als in kleine ringen is de rotatie rond pi-bindingen ook beperkt: door de “side-on” overlap van pi-bindingen kan men een pi-binding niet draaien zonder deze te breken., Dit staat in tegenstelling tot conventionele sigma-bindingen (enkelvoudige bindingen) in acyclische moleculen, waar vrije rotatie mogelijk is: getuige 1,2-dichloorethaan (linksonder).
daarom kunnen we moleculen zoals cis-1,2-dichlooretheen en trans-1,2-dichlooretheen hebben die van elkaar kunnen worden gescheiden vanwege hun verschillende fysische eigenschappen.
we kunnen ook de cis–trans-nomenclatuur gebruiken om isomeren zoals 2-methyl-3-hexeen (boven rechts) te onderscheiden., In het cis-isomeer bevinden de twee waterstofatomen zich aan dezelfde kant van de pi-binding, en in het trans-isomeer bevinden de twee waterstofatomen zich aan de andere kant van de binding.
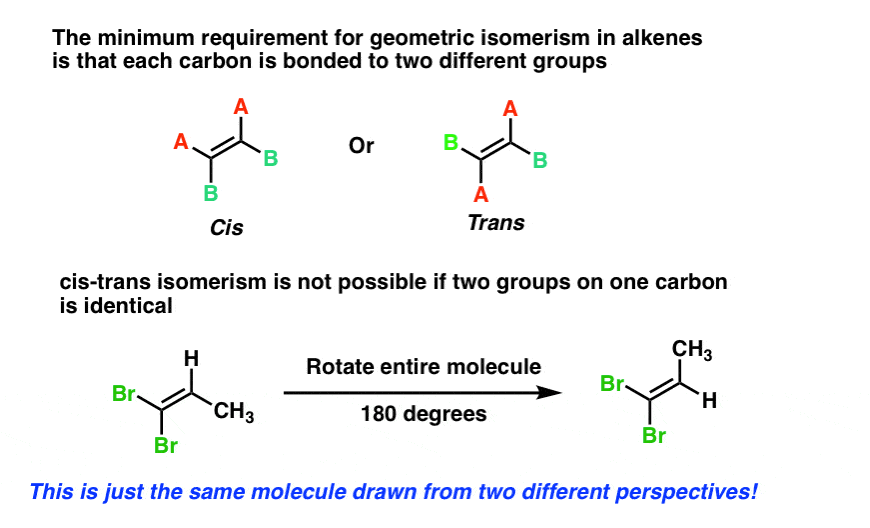
net als bij ringen is het minimumvereiste voor cis-trans-isomerisme in alkenen dat elke koolstof aan twee verschillende groepen gebonden is en dat de twee koolstofatomen ten minste één substituent gemeen hebben.
net als bij ringen is cis-transisomerisme niet mogelijk als een van de koolstofatomen van de dubbele binding aan twee identieke groepen is verbonden, zoals bij 1,1-dibroom-1-propeen hieronder. Probeer het zelf als je niet overtuigd bent.,
3. Kijk uit voor dubbelzinnige namen waar Cis/Trans isomerisme mogelijk is
een snelle uitweiding: een gevolg van onze pas ontdekte appreciatie van geometrisch isomerisme is dat veel eenvoudig klinkende molecuulnamen eigenlijk dubbelzinnig zijn.
de descriptor “3-hexeen” beschrijft bijvoorbeeld niet eenduidig een specifiek molecuul. . Om de specifieke molecule vast te leggen, moeten we cis– of trans– 3-hexeen specificeren.,
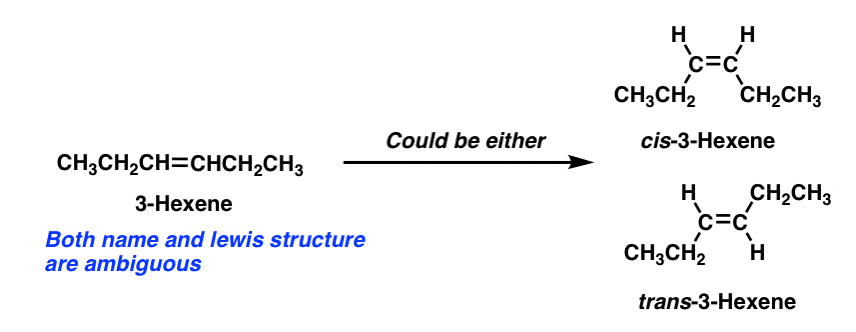
merk op dat 1-hexeen nog steeds OK is, aangezien de 1-positie van 1-hexeen aan twee identieke groepen (hydrogenen) is gehecht en dus geen cis–trans-isomeren mogelijk zijn.
4. Cis – Trans-isomerisme voor cyclische alkenen
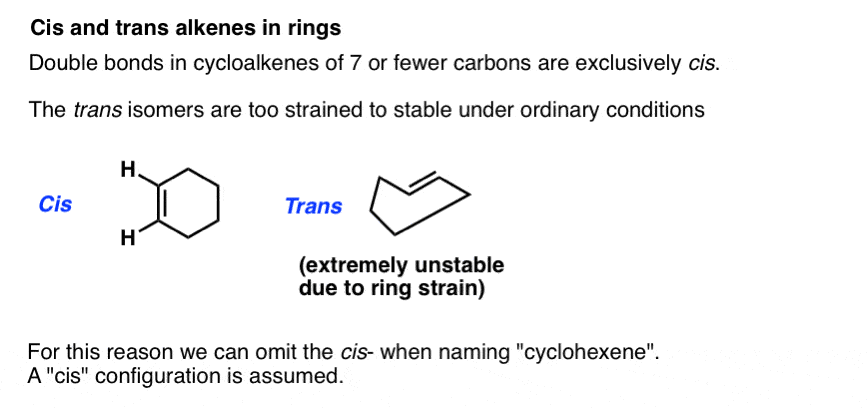
cis – en trans kan ook worden toegepast op alkenen in ringen. Op papier is het bijvoorbeeld mogelijk om cis– en trans– cyclohexeen te tekenen, omdat de pi – binding voldoet aan de vereisten voor cis – trans-isomerisme. In werkelijkheid is trans-cyclohexeen onmogelijk gespannen. Probeer jezelf eens op het stuitje te kussen., Dat zal je een idee geven van de spanning die betrokken is bij het proberen om een trans– dubbele binding in een ring met zes leden op te nemen .
daarom is het voor ringgrootten 7 en lager veilig om het schrijven van “cis” te negeren : de configuratie wordt aangenomen.
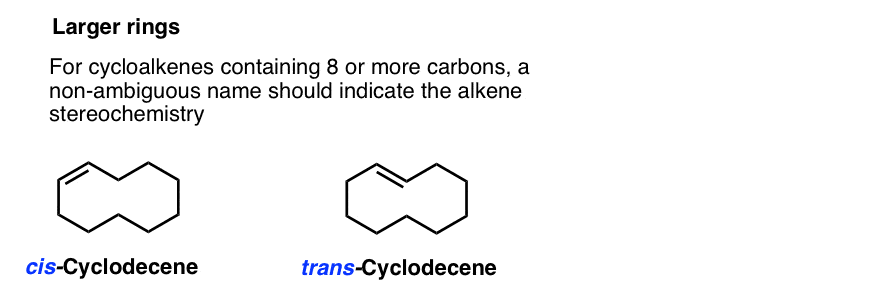
bij ringgroottes van 8 en hoger moeten we een cis– of trans – in de naam zetten, omdat de trans– isomeer haalbaar wordt. (Stel je voor dat je jezelf probeert te kussen op het staartbeen als je de nek van een giraffe had: plotseling niet onmogelijk!,)
een oplossing voor wanneer” Cis “en” Trans ” falen: het E/Z-systeem
we zagen dat cis en trans falen in ringen wanneer de twee koolstofatomen een gemeenschappelijke substituent ontbraken. Onder deze omstandigheden faalt het ook voor alkenen.
voorbeeld: probeer cis en trans toe te passen op het onderstaande alkeen:
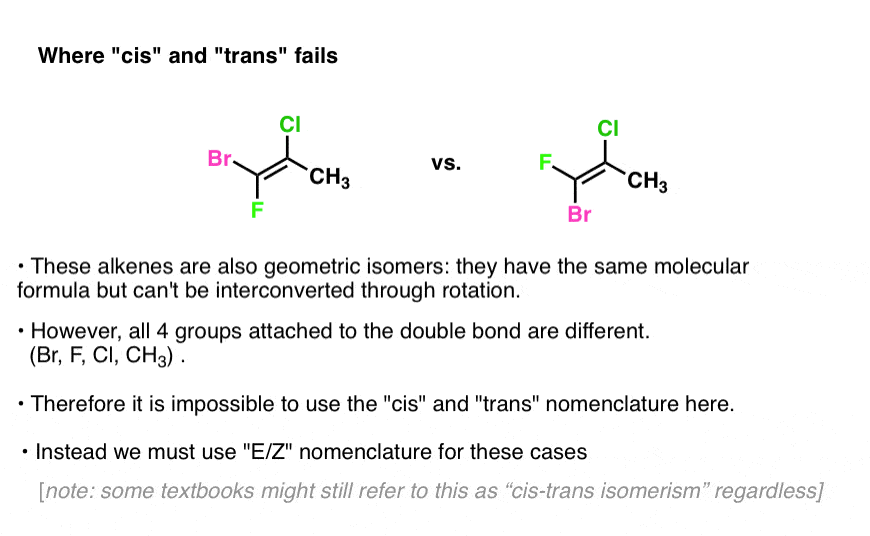
zie het probleem?
bij afwezigheid van twee identieke groepen, hebben we geen referentiepunt!
aan de linkerkant is het chloor cis naar Br en trans naar F. maar rechtvaardigt dat echt het noemen van de isomeer “cis” ? Hoe beslissen we?,
wat we nodig hebben is een manier om prioriteiten te bepalen in deze situaties.
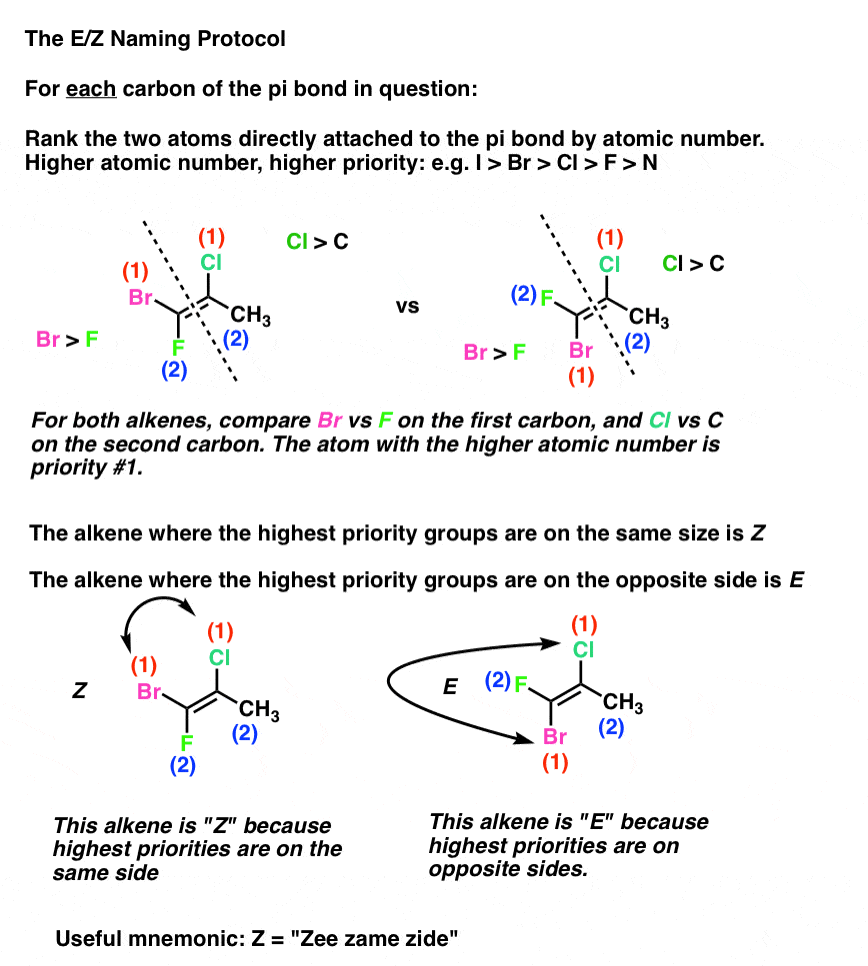
de E-en Z-notatie voor alkenen
gelukkig kunnen we het rangschikkingssysteem dat is ontwikkeld door Cahn, Ingold en Prelog voor chirale centra toepassen (zoals besproken in dit eerdere bericht op (R) / (S) nomenclatuur) voor dit doel.
het protocol is als volgt:
- elke koolstof in de pi-binding is verbonden met twee substituenten. Voor elke koolstof worden deze twee substituenten gerangschikt (1 of 2) volgens de atoomnummers van het atoom dat direct aan de koolstof is verbonden. (bijv., Cl > F)
- als beide substituenten met de rang 1 aan dezelfde zijde van de pi-binding staan, krijgt de binding de descriptor Z (afkorting voor Duits Zusammen, wat “samen”betekent).
- als beide substituenten met de rang 1 Aan de andere kant van de pi-obligatie staan, krijgt de obligatie de descriptor E (afkorting voor Duits Entgegen, wat “tegengesteld”betekent).
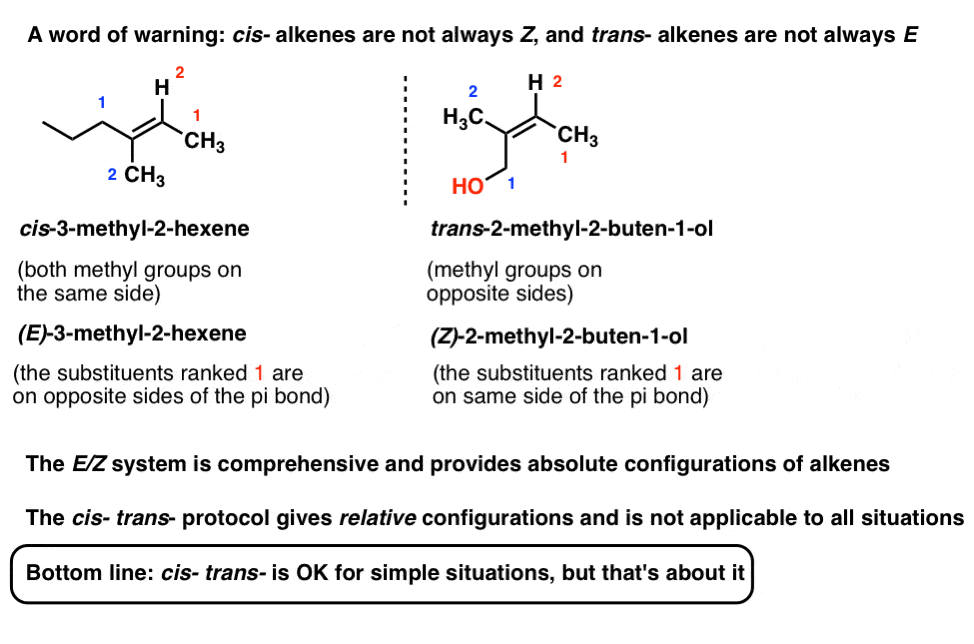
dus Z lijkt op ” cis “en E lijkt op” trans”. (Opmerking: ze zijn niet noodzakelijk hetzelfde en correleren niet altijd: Zie voetnoot voor een voorbeeld van een cis-alkeen dat E is ., Het E / Z-systeem is uitgebreid voor alle alkenen die in staat zijn tot geometrisch isomerisme, met inbegrip van de cis/trans-alkeenvoorbeelden hierboven. We gebruiken vaak cis/trans voor het gemak, maar E / Z is de “officiële”, IUPAC goedgekeurde manier om alkeen stereoisomeren te noemen].
een eenvoudige manier om Z te onthouden is door “Zee Zame Zide” in een Duits accent te zeggen. Mijn manier om het te doen was doen alsof de Z staat voor “zis”. Wat voor jou werkt.,
Hier is een praktisch voorbeeld:
net als bij chirale centra kan rangschikking volgens atoomnummer resulteren in banden als we ons beperken tot de atomen die direct verbonden zijn met de pi-bindingen.
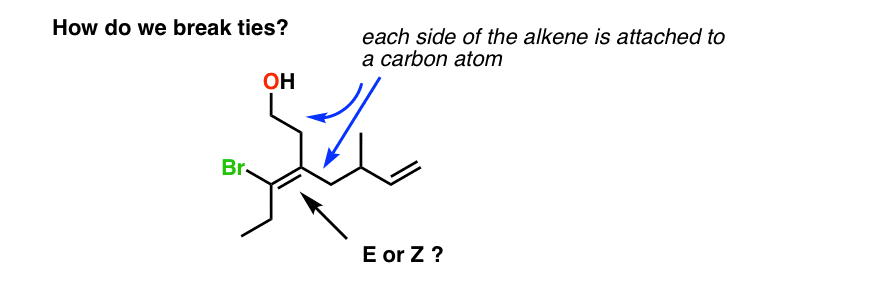
7. Breaking Ties: de methode van Dots
bijvoorbeeld, het alkeen hieronder stelt ons voor een dilemma: een van de koolstofatomen van het alkeen is verbonden met twee koolstofatomen. Dus hoe bepalen we prioriteiten in dit geval. Hoe breken we banden?
In het geval van ties moeten we de methode dots toepassen., Stippen zijn handige placeholders dat is waarom ik graag deze methode te gebruiken.
- plaats een punt op elk van de twee atomen die u vergelijkt.
- vermeld de 3 atomen waaraan elk atoom is gehecht, in volgorde van atoomnummer.
- vergelijk de lijsten, net zoals je een set van drie speelkaarten zou vergelijken. Net zoals een hand van (8, 8, 7) zou verslaan (8, 7, 7), zo zou (C, C, H) verslaan (C, H, H).
- als de lijsten identiek zijn, verplaats de punten naar het atoom met de hoogste prioriteit in de lijst.
- op het eerste punt van verschil, toewijzen (E of Z).,
- als er geen verschil is … dan zijn de groepen identiek, en E / Z is niet van toepassing.
Hier is een praktisch voorbeeld van de”methode van punten”. 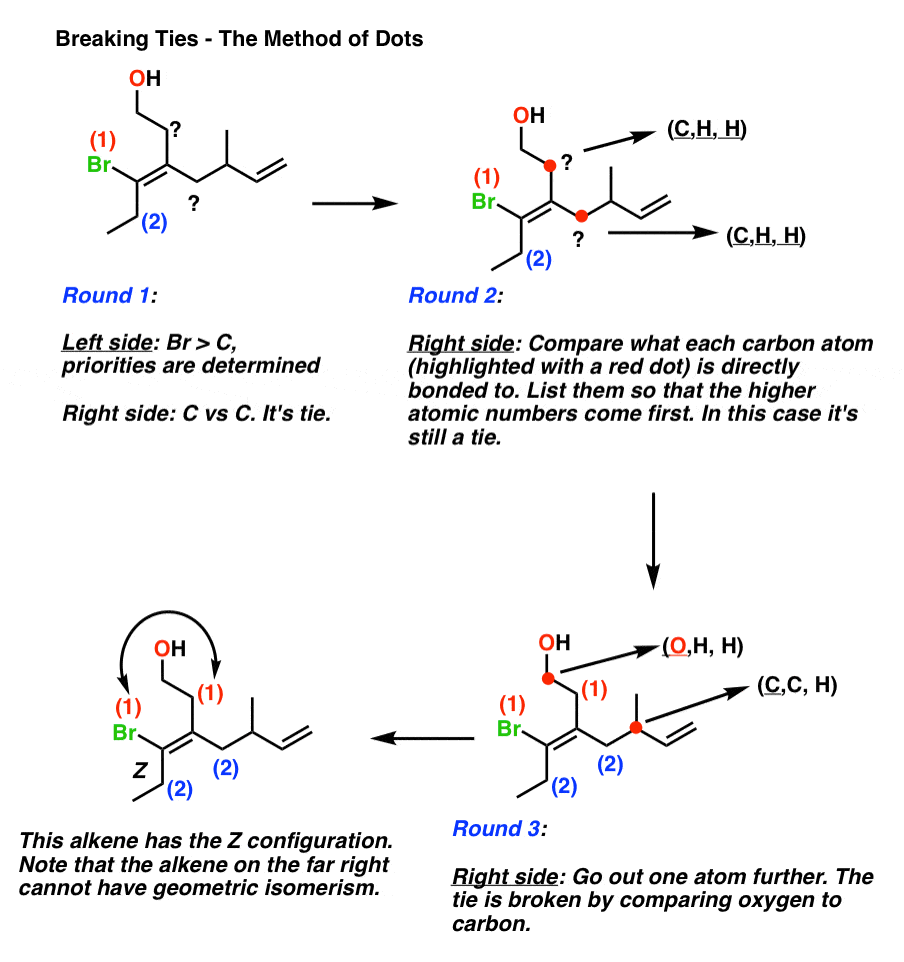
Hier is een complexer voorbeeld met meerdere alkenen. In dit geval wordt elke pi-binding aangeduid door een getal met een eigen afzonderlijke e-of Z-configuratie.
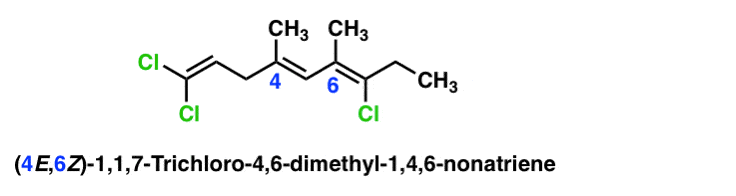
OK, dit was lang. Maar hopelijk nuttig.
kijk uit voor een toekomstig bericht waarin we meer in detail ingaan op de “methode van punten”.
8., Conclusie: E-en Z-notatie voor alkenen
cis-trans-is OK voor het beschrijven van enkelvoudige alkeenstereoisomeren, maar werkt alleen in bepaalde gevallen. Bovendien geeft het alleen relatieve configuraties. Het E / Z-systeem is uitgebreid en beschrijft de absolute configuratie van de molecule.
zie hieronder voor een voorbeeld van een e-alkeen dat “cis” is en een Z-alkeen dat “trans”is.
even ter herinnering: Dit artikel werd geschreven door Matt Pierce van Organic Chemistry Solutions. Vraag Matt over het plannen van een online tutoring sessie hier.,
noten
Noot 1: Het is mogelijk om een alkeen te hebben dat we zouden beschrijven als ‘cis’ be E en vice versa.
E / Z heeft de voorkeur, omdat het absolute configuratie beschrijft, terwijl cis – trans – alleen relatieve configuratie beschrijft.
Opmerking 2: trans-cyclopropeen, trans-cyclobuteen en trans-cyclopenteen zijn nooit gesynthetiseerd of waargenomen. trans-cyclohexeen is een laboratorium nieuwsgierigheid, stabiel op een paar graden boven het absolute nulpunt. trans-cyclohepteen heeft een extreem korte halfwaardetijd bij kamertemperatuur., trans-cycloocteen is een stabiel molecuul .
Quiz zelf!,v>
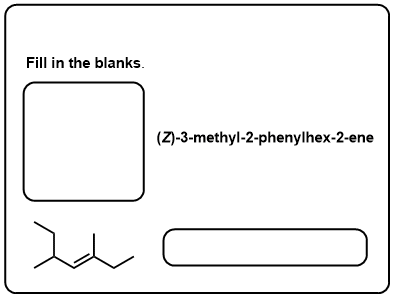 Klik op Spiegelen
Klik op Spiegelen
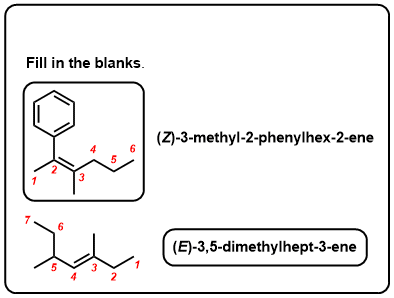
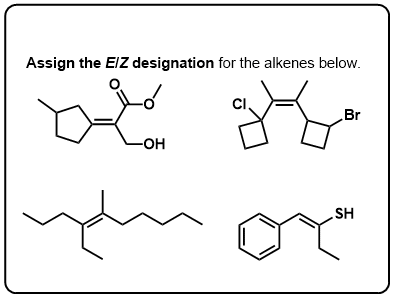 Klik op Spiegelen
Klik op Spiegelen
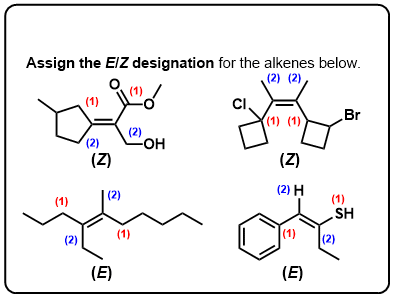
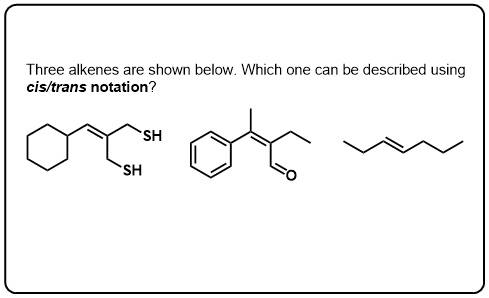 Klik op Spiegelen
Klik op Spiegelen
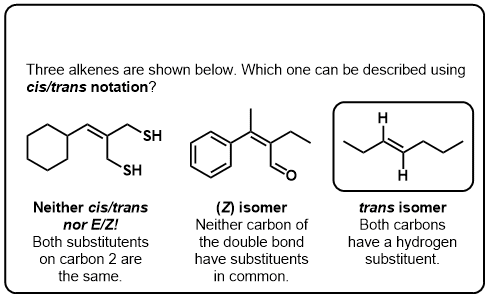
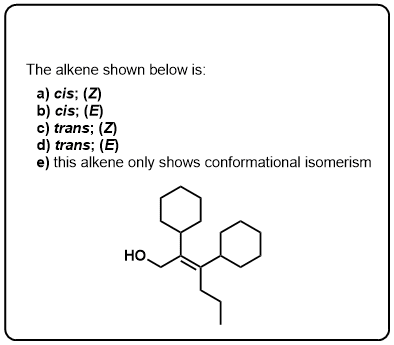 Klik op Spiegelen
Klik op Spiegelen

 Klik op Spiegelen
Klik op Spiegelen 
 Klik op Spiegelen
Klik op Spiegelen 
 Klik op Spiegelen
Klik op Spiegelen 
 Klik op Spiegelen
Klik op Spiegelen 