Qu’est-ce qu’un sucre réducteur, et pourquoi est-il important? Voici un résumé rapide. Tous les détails dans le post ci-dessous.,
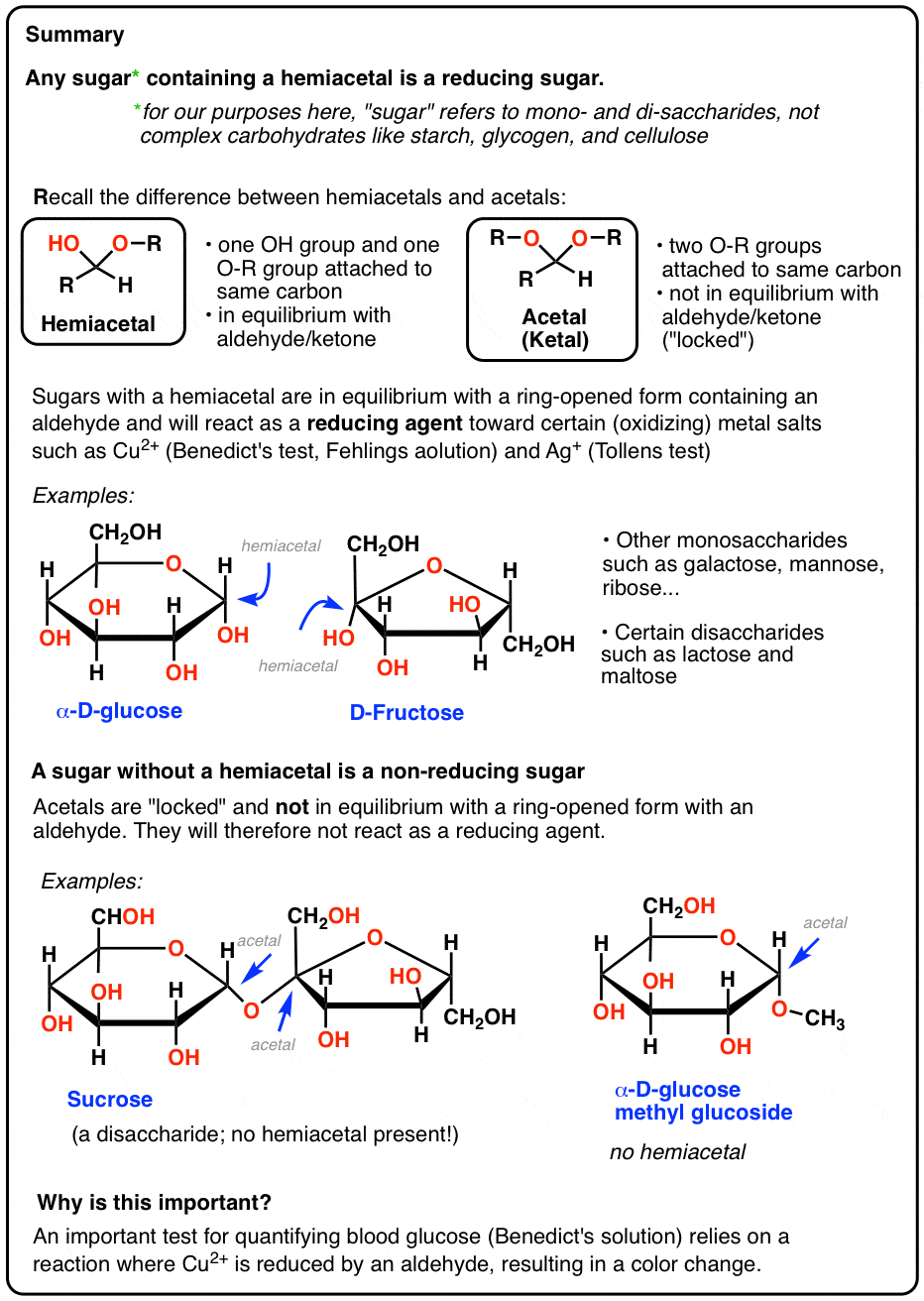
table des matières
- avant de parler de sucres réducteurs, la chimie du « pipi sur le bâton”
- tests de Benedict, Fehlings et Tollens: trois « Tests” visuels pour la présence d’aldéhydes
- sucres réducteurs: les sucres avec un groupe fonctionnel hémiacétal donnent des Tests positifs car ils sont en équilibre avec un aldéhyde à chaîne ouverte
- alors qu’est-ce qu’un sucre réducteur?
- Les Saccharides dépourvus D’hémiacétal ne sont pas des sucres réducteurs
- Polysaccharides Complexes avec une seule unité hémiacétal (par exemple, L’amidon) ne sont pas des sucres réducteurs
- Testez-vous sur les sucres réducteurs
- La chimie des tests Benedict, Fehlings et Tollens
- Notes
- références(avancées) et lectures complémentaires
1. Avant de parler de la réduction des sucres: la chimie du « pipi sur le bâton”
Q. Pouvez-vous penser à une situation où il pourrait être utile de pouvoir mesurer la concentration de glucose dans une solution (en particulier dans le sang ou l’urine) ?
A. diabète., Une fois que vous avez un moyen de mesurer rapidement et facilement la concentration de sucre, vous pouvez déterminer la quantité d’insuline nécessaire pour la contrer.
la question Suivante. Quel serait un moyen facile et visuel de détecter la présence de glucose? Surtout quelque chose qui ne vous oblige pas à être un chimiste expert?
Idéalement, vous aimeriez une réaction chimique qui entraîne un changement de couleur.
pensez aux tests de grossesse: vous faites simplement pipi sur un bâton et savez en quelques minutes si vous êtes enceinte. Vous n’avez pas besoin de connaître la chimie. C’est sans cervelle.,
Un test de glycémie adapté aux diabétiques devrait avoir une facilité d’utilisation similaire.
cela nous amène (via les aldéhydes) au sujet de la réduction des sucres, car ils sont à la base d’un test historiquement important basé sur la couleur pour la glycémie.,
trois « Tests” visuels pour la présence d’Aldéhydes: les Tests de Benedict, Fehlings et Tollens
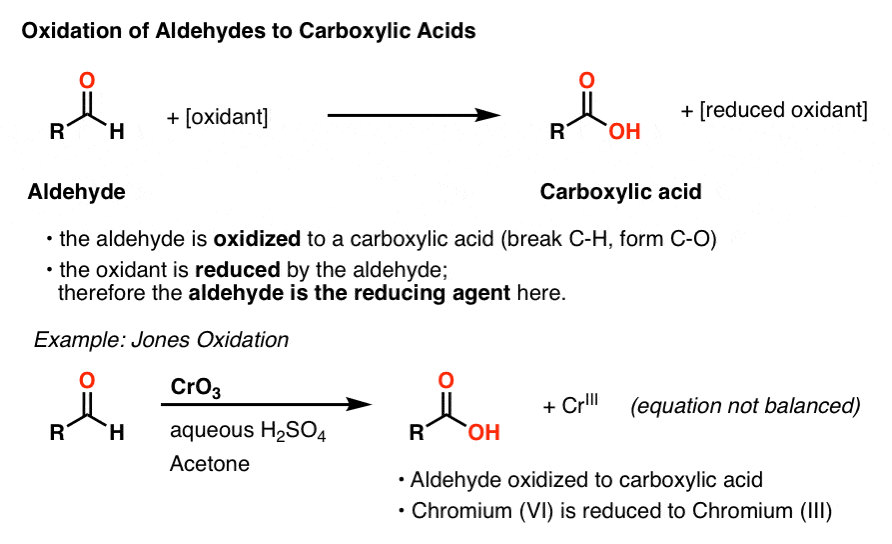
avant d’arriver aux sucres, parlons de l’oxydation des aldéhydes.
nous avons vu précédemment que les aldéhydes sont un groupe fonctionnel qui peut être oxydé relativement facilement en acides carboxyliques. Par exemple, l’oxydation des alcools avec un oxydant « fort” comme l’acide chromique (h2cro4) donne un aldéhyde qui est rapidement oxydé en un acide carboxylique.
au Cours de ce processus, l’aldéhyde est oxydé et l’agent oxydant est réduit., Une autre façon de cadrer ceci est de dire que l’aldéhyde est l’agent réducteur dans ce procédé.
la liste des réactifs pouvant être utilisés pour oxyder les aldéhydes en acides carboxyliques est loooong. Parmi celles-ci, quelques méthodes se distinguent en fournissant une indication visuelle particulièrement claire que la réaction a été achevée.
Trois tests « visuels” pour les aldéhydes que vous pourriez rencontrer dans un laboratoire d’introduction à la chimie organique sont les suivants:
- solution de Fehling, où un aldéhyde change la couleur d’une solution de Cu(II) bleue en cu(I) rouge .,
- solution de Benedict une version légèrement modifiée de la solution de Fehling
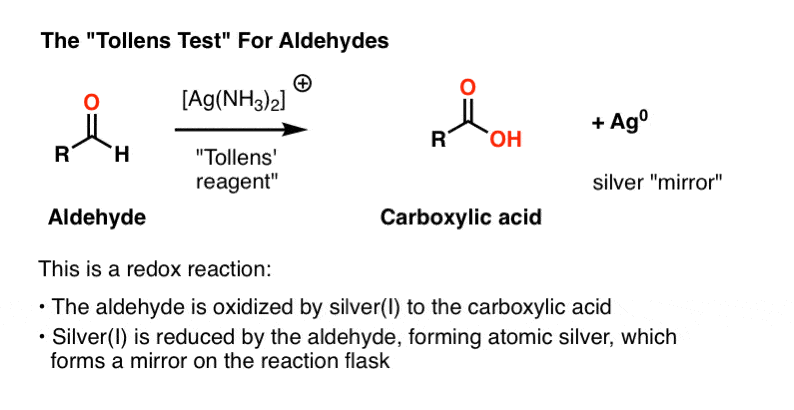
- Test de Tollens, où l’oxydation de l’aldéhyde entraîne un beau « miroir” de métal argenté à précipiter sur le récipient de réaction.

il est Important, cétones ne pas réagir dans l’une de ces conditions. Les tests ci-dessus ont également été un moyen utile de distinguer les aldéhydes des cétones dans les jours sombres avant que la spectroscopie IR et RMN ne fasse cette routine.
alors, qu’est-ce que cela a à voir avec les sucres?, Revenons au mode CRI:
sucres réducteurs: les sucres avec un groupe fonctionnel hémiacétal donnent des Tests positifs car ils sont en équilibre avec un aldéhyde à chaîne ouverte
Comme nous l’avons vu, le glucose est en équilibre avec une forme à chaîne ouverte (ou « linéaire”) contenant un aldéhyde.
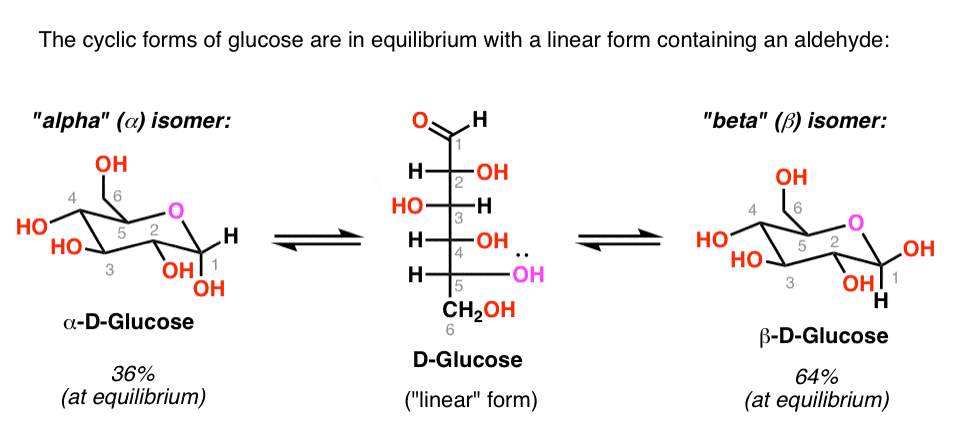
la concentration d’aldéhyde à un moment donné est faible (<1%), mais suffisamment longue durée pour être piégée avec le bon réactif.,
cela signifie que le glucose donnera un test positif avec le réactif de Benedicts, la solution de Fehlings ou le test de Tollens, et que l’aldéhyde sera oxydé en acide carboxylique.
Voila! Un simple changement de couleur vous indique si du glucose est présent!

source de l’image
Qu’en est-il de la quantification?
c’est bien d’avoir un test visuel rapide pour le glucose., Mais que faire si nous voulons déterminer la concentration exacte de glucose dans une solution, disons, d’urine ou de sang?
dans ce cas, une formulation légèrement différente de la solution de Benedicts est utilisée, ce qui donne un précipité incolore plutôt qu’une couleur rouge. Une solution de l’échantillon à analyser est ajoutée, via buret, à un flacon contenant une quantité connue de solution de bénédictions jusqu’à ce que la couleur bleue du Cu(II) disparaisse. L’échantillon inconnu est ensuite étalonné à l’aide d’une solution à 1% de glucose.
Le dosage de Benedicts a été la méthode de choix pour quantifier le glucose pendant plus de 50 ans., Un chercheur se souvient que tous les intronisés dans l’armée américaine pendant la Seconde Guerre mondiale avaient leur urine testée pour le sucre avec la Solution de Benedict.
ces derniers temps, cependant, L’utilisation de la solution de Benedict a été supplantée par des méthodes enzymatiques telles que la glucose oxydase. Pourquoi?
Le test Benedict n’est pas spécifique au glucose; il vous indique simplement si un aldéhyde est présent. Donc, il donnera également un test positif pour d’autres sucres réducteurs.,
en bref, tout sucre* (*mono – ou disaccharide) avec un hémiacétal donnera également un test positif, car ces sucres sont en équilibre avec un aldéhyde à chaîne ouverte. Donc, si le sang / urine contient des monosaccharides communs comme le mannose, le galactose ou le fructose, ceux-ci délivreront un test positif. En d’autres termes, ces sucres sont également des sucres réducteurs. 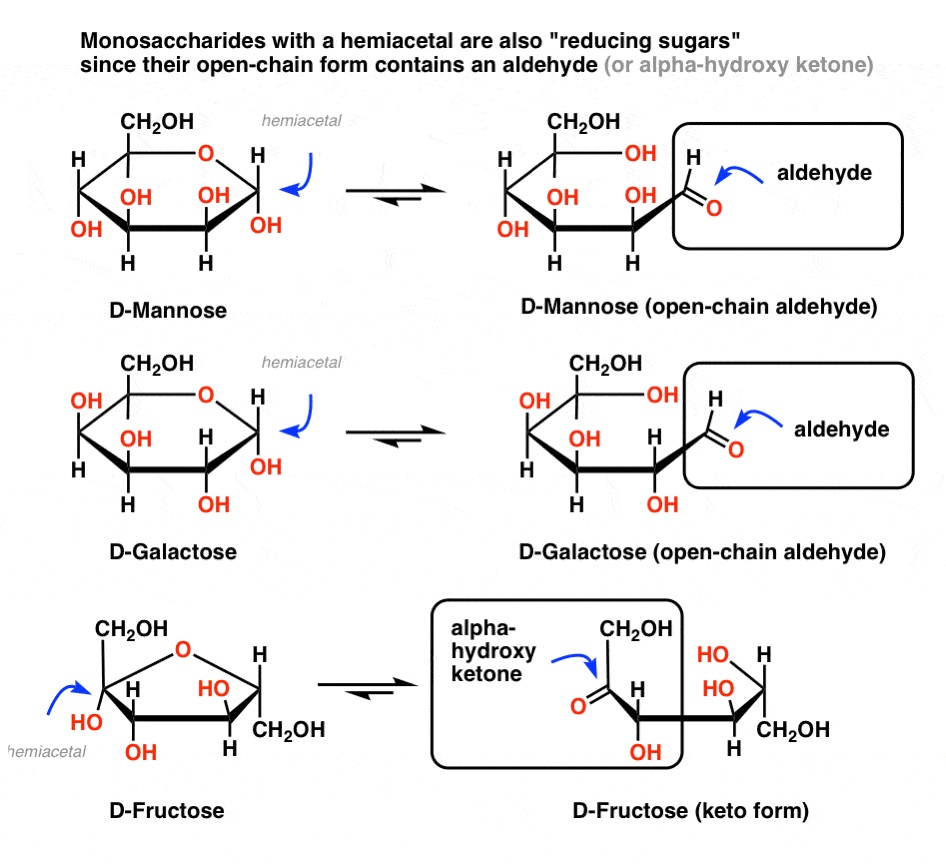
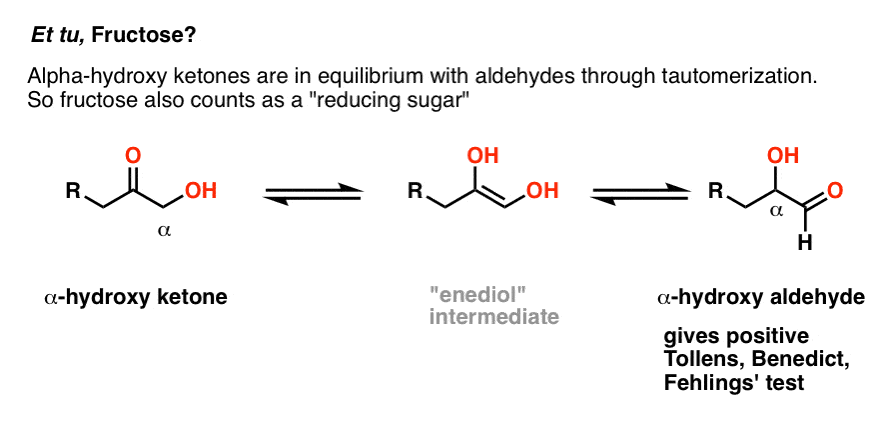
Maintenez pendant une seconde. Et tu, fructose?
les cétones ne sont pas censées s’oxyder dans ces conditions! Alors, pourquoi le fructose donne-t-il un test positif?
bonne question., Bien que le fructose soit un sucre céto et que les cétones donnent généralement un test négatif avec le Benedict, il existe une exception. Si le carbone adjacent au carbone cétone (le « carbone alpha”) contient un groupe hydroxyle, la cétone sera en équilibre avec un aldéhyde par tautomérisation (pour mémoire, c’est ce qu’on appelle un « réarrangement enediol”).
de même, certains disaccharides tels que le maltose et le lactose contiennent un hémiacétal., Ils réduisent également les sucres qui donnent un test positif de Fehlings, Benedict ou Tollens (l’image du test positif au lactose est plus bas).
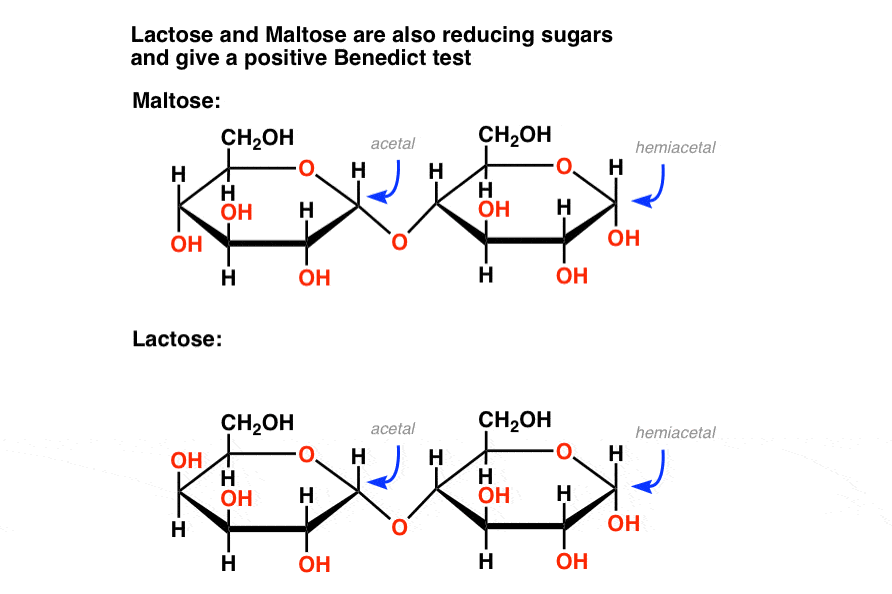
l’essentiel est que le réactif de Benedicts quantifie les sucres réducteurs, ce qui comprend non seulement le glucose, mais aussi le mannose, le lactose, le maltose, le fructose et d’autres. Cela signifie que le test n’est pas aussi précis que nous aimerions!
alors, qu’est-ce qu’un sucre réducteur?
Jusqu’à présent, il semble que chaque sucre que nous avons rencontré est un sucre réducteur. Il est donc juste de demander: quand un sucre n’est-il pas un sucre réducteur?,
deux cas principaux:
- mono et di-saccharides dépourvus d’hémiacétal
- polysaccharides où le rapport entre les hémiacétaux et les liaisons acétal est très faible (par exemple l’amidon)
les Saccharides dépourvus d’hémiacétal ne sont pas des sucres réducteurs
Nous avons vu en haut du post que les hémiacétaux sont en équilibre avec un aldéhyde ou une cétone. En revanche, les acétals (cétals) sont verrouillés en place et ne peuvent être reconvertis en aldéhyde ou cétone qu’avec de l’acide aqueux. C’est pourquoi ils font d’excellents groupes protecteurs pour les aldéhydes/cétones.,
l’enfant affiche d’un sucre non réducteur est le saccharose, alias sucre de table.
le Saccharose est un disaccharide de glucose et de fructose. Voyez si vous pouvez trouver un hémiacétal dans sa structure, ci-dessous:
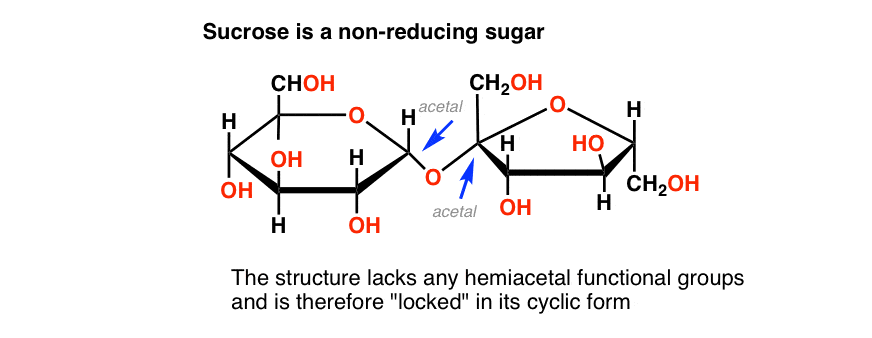
Il n’y en a pas! Le saccharose n’a que des groupes acétal, et puisque les acétals ne s’ouvrent pas aux aldéhydes dans les conditions de base présentes dans le test Benedict, le saccharose n’est pas un sucre réducteur.
le saccharose donne un test négatif (bleu) à la solution Benedict.,
un autre exemple de sucre non réducteur sont les soi-disant « glucosides” de sucres communs, tels que le glucose méthyl glucoside, ci-dessous. Ceci est obtenu en chauffant du glucose dans du méthanol acide.
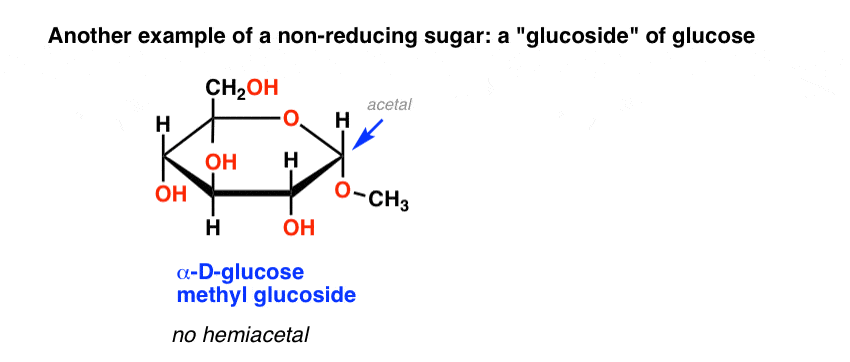
dépourvu d’hémiacétal pouvant s’ouvrir sur un aldéhyde, ce méthyl glucoside donne également un test de Benedict négatif.
les Polysaccharides complexes qui N’ont Qu’une seule unité Hémiacétale ne comptent pas comme sucres réducteurs (par exemple L’amidon)
Les sucres peuvent former de longues chaînes les uns avec les autres dans des arrangements appelés polysaccharides., Les exemples courants de polysaccharides sont l’amidon, la cellulose et le glycogène.
la grande majorité des unités de sucre individuelles de ces polysaccharides sont reliées les unes aux autres par des liaisons acétal (« glycosidiques »). Les hémiacétals sont présents, mais seulement à la terminaison du polymère.
L’amidon, par exemple, A Généralement environ 300-600 unités individuelles de glucose, mais une seule unité (le terminus) a un hémiacétal.
Une « aiguille” hémiacétale dans une botte de foin d’ « acétals” ne suffit pas pour donner un test positif pour la réduction des sucres. Par conséquent, ces polysaccharides ne sont pas considérés comme des sucres réducteurs., Par exemple, l’amidon donne un test négatif (voir ci-dessous).
Voici un exemple de test de Benedict avec du lactose, de l’amidon, du glucose, du fructose et du saccharose (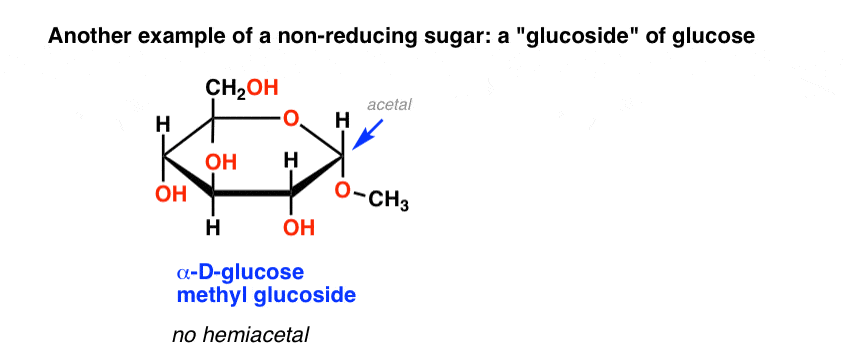
notez que l’amidon et le saccharose sont bleus, les classant comme des sucres non réducteurs.
cela suffit sur ce qui classe un « sucre réducteur” d’un « sucre non réducteur”.
Voici la dernière étape. Testez-vous. Ce qui est un sucre réducteur et ce qui ne l’est pas?
7. Testez-vous sur la réduction des sucres
avez-vous du sens? Demandez – vous si les sucres suivants sont des sucres réducteurs ou des sucres non réducteurs.,
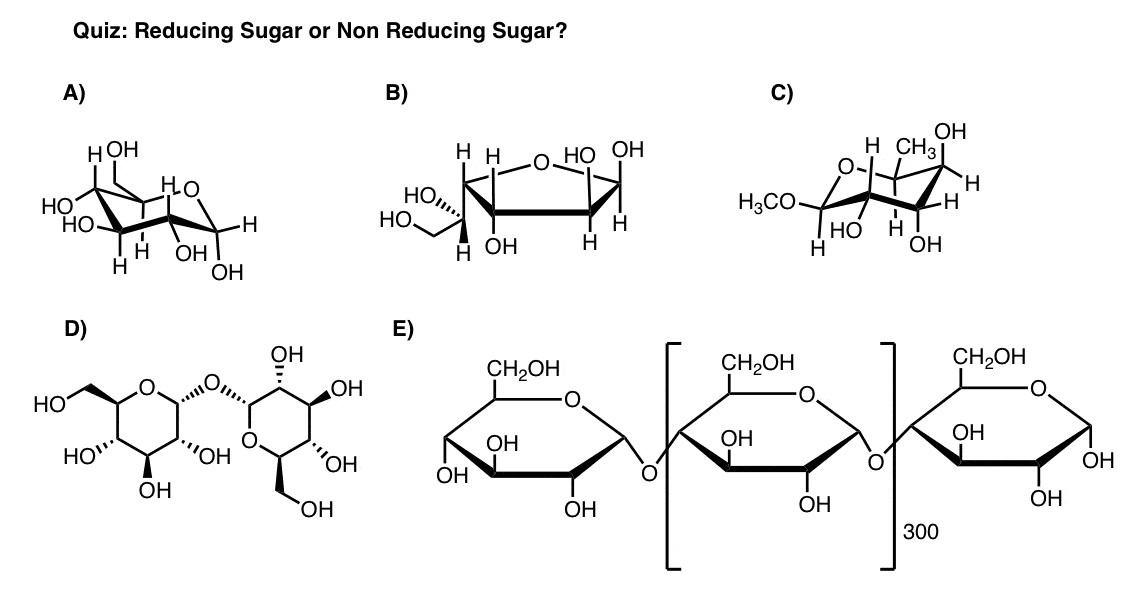
Si vous n’avez pas besoin de savoir autre chose que « qu’est-ce qu’un sucre réducteur”, vous avez terminé ici.
Mais si vous voulez aller plus loin dans le rabbit hole, je vous invite à lire plus loin pour en savoir plus sur
la chimie des tests Benedict, Fehlings et Tollens
alors que se passe-t-il réellement dans les tests Benedict, Fehlings et Tollens? Nous allons discuter des détails de la chimie.
Une chose à propos des trois tests est que le réactif actif n’est pas particulièrement stable au banc et doit être fraîchement préparé.,
Solution de Fehling
pour la solution de Fehling, on commence par du sulfate de cuivre(II) bleu vif, de l’hydroxyde de sodium et du tartrate de sodium de potassium (autrement connu sous le nom de sel de Rochelle). Le but derrière l’utilisation du tartrate est qu’il se coordonne au cuivre(II) et aide à l’empêcher de s’écraser hors de la solution.
Une fois préparé, la substance à analyser est ajoutée et le mélange est chauffé pendant une brève période.
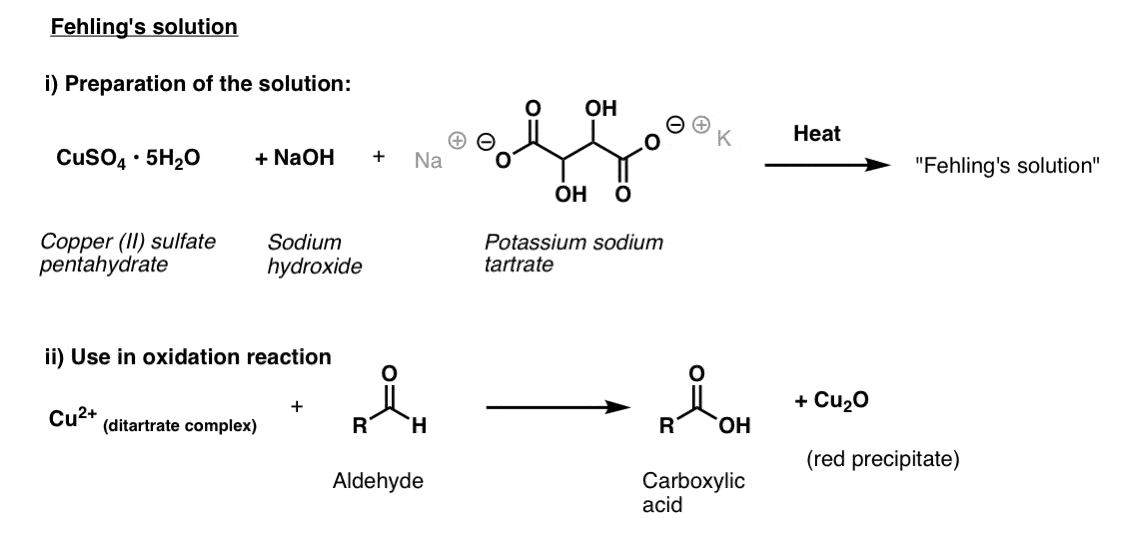
Il en résulte un acide carboxylique et du Cu rouge(I) qui précipite sous forme d’oxyde de cuivre(I).,
la structure de l’espèce active dans la solution de Fehling a été déterminée; il s’agit d’un complexe de cuivre plan carré attaché à deux ligands de tartrate.
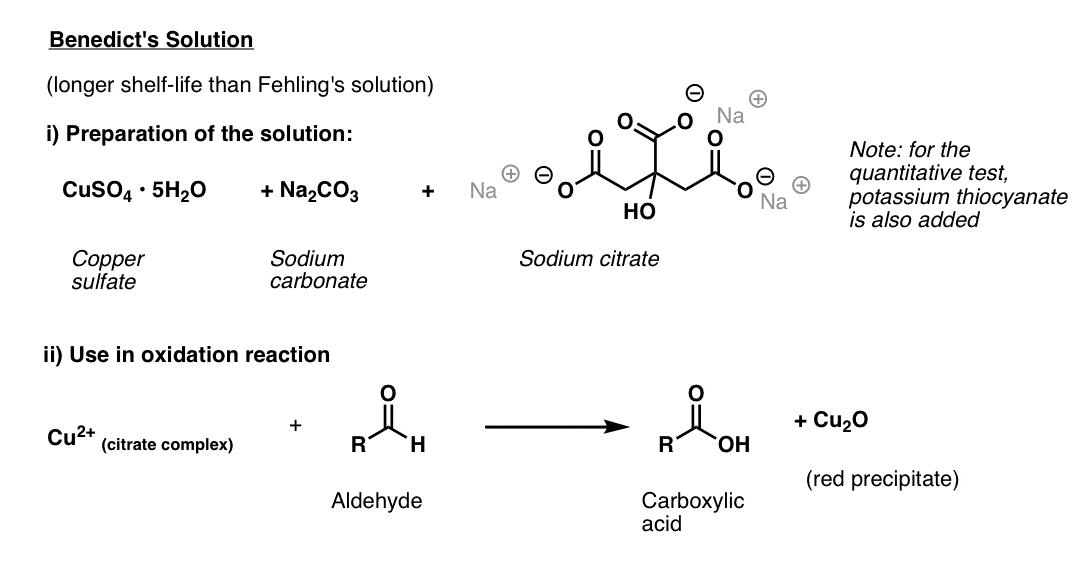
la Solution de Benedict
La solution de Benedict est une légère variation de la solution de Fehling qui utilise du citrate au lieu du tartrate, ce qui fournit une meilleure stabilité pour le cuivre(II).
comme la solution de Fehling, il est préférable de la faire fraîche. Les ingrédients sont le sulfate de cuivre (II), le carbonate de sodium (remarque: l’hydroxyde est également nécessaire! – voir référence), et citrate de sodium., (Note: dans l’essai quantitatif, du thiocyanate de potassium est ajouté, ce qui donne un précipité blanc incolore).
l’essai est effectué en ajoutant la substance à analyser et en chauffant brièvement.
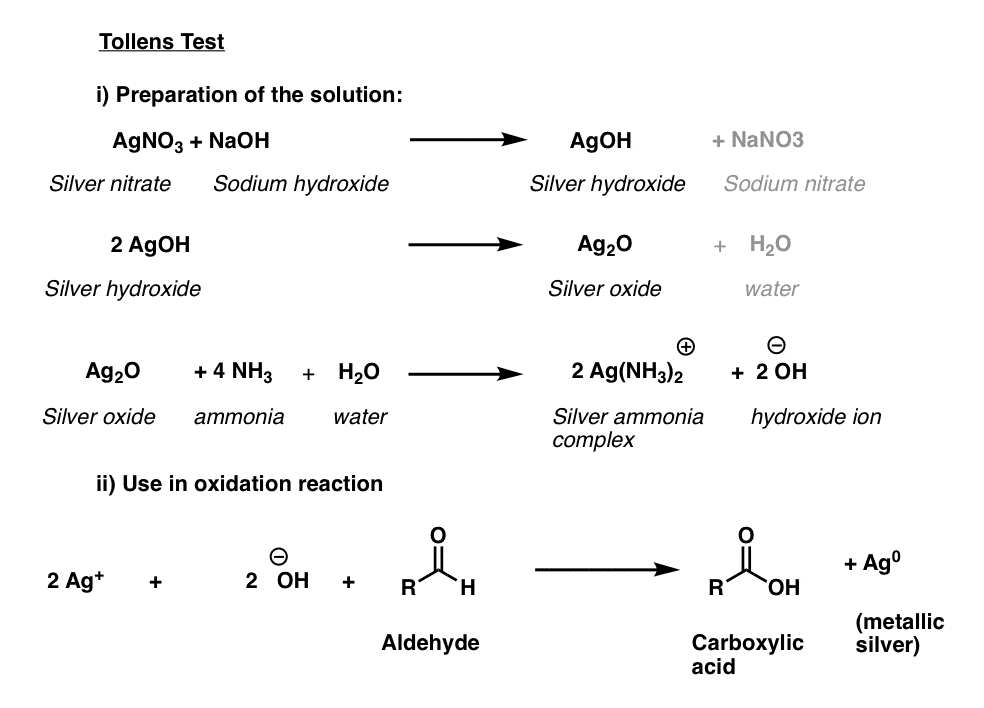
solution de Tollens
l’ingrédient actif du test de Tollens, + , n’a pas une longue durée de conservation et, comme les solutions de Fehlings et Benedict, est mieux préparé frais.
Les trois premières lignes ci-dessous décrivent la procédure. Le nitrate d’argent est converti en hydroxyde d’argent, qui forme L’oxyde d’argent (I), Ag2O., Ensuite, l’addition d’Ammoniac aqueux (NH3) entraîne la formation du complexe argent-ammoniac qui est l’oxydant actif.
L’échantillon à tester est ensuite ajouté à l’fraîchement préparé actif oxydant dans une solution de base. Un test positif entraîne la précipitation d’un beau miroir de métal argenté sur le récipient de réaction. (Une variante de cette procédure est utilisée pour la préparation de miroirs).
Comment Ça marche?
La première chose à noter est que toutes ces procédures se produire dans la solution de base.
pourquoi?, Il y a au moins deux bonnes raisons à cela dont nous pouvons parler.
- tout d’abord, les conditions acides peuvent hydrolyser les acétals présents dans les hémiacétals, donnant un test faussement positif.
- Deuxièmement, base accélère considérablement le taux de tautomérisme à chaîne annulaire (c’est-à-dire interconversion entre la forme hémiacétale cyclique et la forme aldéhyde linéaire).
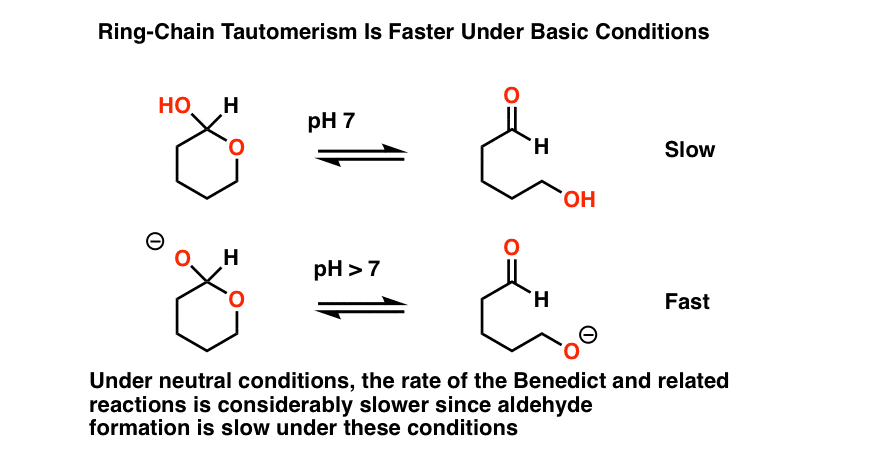
ligne de Fond ici est que l’ajout de base a pour effet d’augmenter la concentration de l’aldéhyde de départ.,
Les détails mécanistes sont troubles et vous ne les trouverez dans aucun manuel D’Introduction
Je ne trouve pas une seule instance du mécanisme pour les solutions Fehlings ou Benedict élucidées de manière concluante en ligne. Si je me trompe, dites-le moi (laissez un commentaire).
Il y a une troisième raison à l’utilisation de base, bien que je ne sois pas très désireux d’en parler. Vous remarquerez que nous n’avons pas mentionné les mécanismes de ces réactions. C’est parce que les mécanismes exacts ont été difficiles à élucider., L’une des étapes clés impliquées dans le mécanisme de chaque réaction semble être un processus appelé « transfert d’un seul électron” qui consiste essentiellement lorsque le sel métallique déverse un seul électron du substrat, créant un radical libre et/ou un carbocation.
l’un des points d’accès pour l’initiation d’une réaction de transfert à un électron est une liaison carbone-métal, qui peut être obtenue par la formation d’un énolate favorisé par la base.
cela nécessite que l’aldéhyde ait un proton sur le carbone alpha (c’est-à-dire qu’il soit « énolisable”)., Il s’avère que la solution de Fehling fait un travail de merde avec des tests pour le benzaldéhyde, qui manque de protons sur le carbone alpha et ne peut pas être énolisé. Ainsi, il semblerait que la réaction doit passer par un énol.
cependant, la solution de Fehling oxyde également le formaldéhyde en acide formique et celui-ci en dioxyde de carbone, et ce processus ne peut pas passer par un intermédiaire énol / énolate.
Il est donc probable qu’une variété de voies mécanistes puissent être en service.
à quoi pourrait ressembler un mécanisme?
Peut-être, éventuellement, quelque chose comme cela?,
passez la souris ici pour une image contextuelle ou
Si quelqu’un d’autre a une meilleure idée, n’hésitez pas à commenter ci-dessous.
Notes
sources de L’Image: solution Benedicts. De Fehling solution. Test Tollens.
Note 1. Cela ne veut pas dire que ce sont les méthodes les plus pratiques pour préparer des acides carboxyliques à partir d’aldéhydes. Lorsque les chimistes veulent préparer un acide carboxylique à partir d’un aldéhyde avec un bon rendement, ils n’utilisent aucun de ces trois procédés. La façon standard de le faire est L’oxydation Pinnick.
Note 2., Le test quantitatif utilise apparemment de l’isocyanate de potassium, ce qui donne un précipité incolore.
Note 3: il est probable que l’intermédiaire enediol soit en fait l’espèce qui réagit avec Cu2+ dans l’étape initiale du mécanisme qui conduit à l’aldéhyde. Voir la section mécanisme.
Note 4. Une chose à noter: si le saccharose est chauffé avec de l’acide aqueux avant un test Fehlings/Benedict/Tollens, un test positif en résultera., C’est parce que les liaisons acétal seront hydrolysées par l’acide aqueux pour produire les deux sucres constitutifs du saccharose (glucose et fructose) qui sont eux-mêmes des sucres réducteurs.
(avancé) références et lectures complémentaires
- Les espèces de la Solution de Fehling
Thomas G. Hörner, Peter Klüfers
J. Inorg. Chem. 2016, 12, 1798-1807
DOI: 10.1002/ejic.201600168
même si l’équation de réaction du test de Fehling peut sembler simple sur le papier, les espèces impliquées sont en fait assez complexes! - la soumission du glutaraldéhyde au test de Tollens
William D., Hill
Journal of Chemical Education 1990, 67 (4), 329
DOI: 1021/ed067p329
Les dialdéhydes donneront également un test de Tollens positif (précipité miroir argenté). - Tollens’s test, fulminating silver,and silver fulminate
Ian D. Jenkins
Journal of Chemical Education 1987, 64 (2), 164
DOI: 10.1021/ed064p164
Le test Tollens est couramment effectué dans les laboratoires de chimie organique de premier cycle, avec des procédures soigneusement testées. Les procédures doivent être robustes car le réactif de Tollens peut être explosif, comme l’explique cette note., - Les tests Fehling et Benedict
Ralph Daniels, Clyde C. Rush et Ludwig Bauer
Journal of Chemical Education 1960, 37 (4), 205
DOI: 10.1021/ed037p205
Cette note est intéressante parce que les auteurs montrent que les tests Fehling et Benedict sont spécifiques pour les hémiacétals dans les sucres réducteurs – ils échouent lorsqu’ils sont utilisés avec des aldéhydes aliphatiques simples. - Une correction sur le Benoît test
William D. Hill
Journal de l’Enseignement de la chimie 1982, 59 (4), 334
DOI: 10.,1021 / ed059p334
plusieurs manuels utilisent Na2CO3 comme base dans le test de Benedict, mais selon cette note, NaOH est nécessaire pour la formation de Cu2