Notation E et Z pour les alcènes
Table des matières
- quand utilisons– nous la Notation cis et trans dans les cycles?
- isomérie cis et trans dans les alcènes
- attention aux noms ambigus lorsque l’isomérie géométrique est possible!,
- cis– et trans– isomérie dans cyclique alcènes
- Lors de la « cis » et « trans‘” échoue: E et Z Notation
- E et Z Notation Pour les Alcènes
- Rupture de Liens: La Méthode des Points
- Conclusion: E et Z Notation Pour les Alcènes
- Notes
- testez-Vous!
Ce post a été co-écrit avec Matt Pierce de Organic Chemistry Solutions. Demandez à Matt de planifier une session de tutorat en ligne ici.,
aperçu rapide: isomérie cis et trans (« isomérie géométrique”) dans les anneaux
plus tôt dans notre série MOC sur les cycloalcanes, nous avons vu qu’une caractéristique clé des petits anneaux est qu’ils ne peuvent pas être tournés « à l’envers” sans rompre les liaisons.
l’une des conséquences les plus importantes de ceci est qu’il peut conduire à l’existence de stéréoisomères – molécules qui partagent la même formule moléculaire et la même connectivité mais ont une disposition différente des atomes dans l’espace.
Ces deux versions du 1,2 dichlorocyclopentane (ci-dessous) sont un exemple., Ils ont la même connectivité – les deux sont du 1,2-dichlorocyclopentane-mais ont des arrangements différents de leurs atomes dans l’espace. Les chlorures sont du même côté de l’anneau dans l’isomère gauche (les deux « coins”, sortant de la page) et sur les côtés opposés (un coin, un pointillé) sur l’isomère droit.
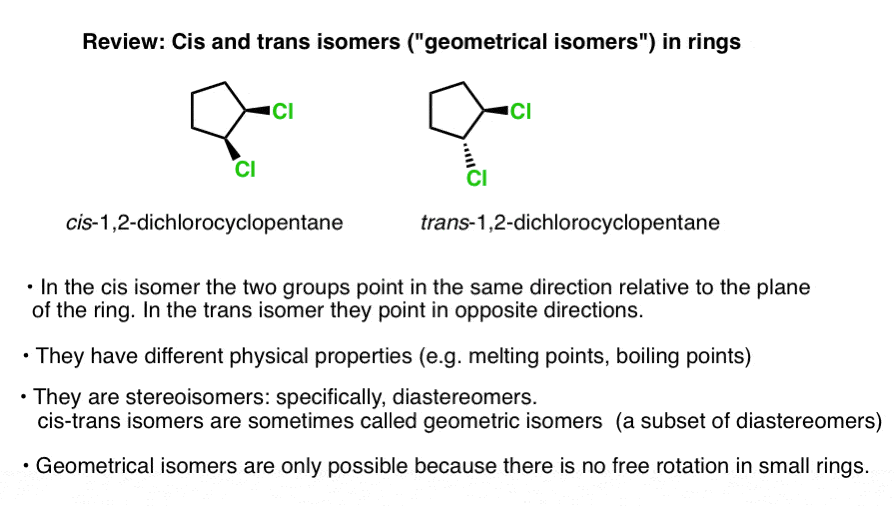
ces deux molécules ne peuvent pas être interconverties par rotation de la liaison C-C sans rompre l’anneau (utilisez un kit de modèle et essayez, si vous le souhaitez). Par conséquent, ils sont des isomères.,
Les molécules qui ont la même connectivité mais une disposition différente dans l’espace sont connues sous le nom de stéréoisomères.
plus précisément, la relation entre les deux molécules ci-dessus est celle des diastéréomères: des stéréoisomères qui ne sont pas des images miroirs l’un de l’autre.
ces deux molécules ont des propriétés physiques différentes – différents points d’ébullition, points de fusion, réactivités, caractéristiques spectrales, etc.
1. Quand utilisons – nous la Notation cis et trans dans les anneaux?,
Nous utilisons les Termes cis – et trans– pour désigner la configuration relative de deux groupes l’un par rapport à l’autre dans les situations où il y a une rotation restreinte.
dans la nomenclature, « cis” est utilisé pour distinguer l’isomère où deux groupes identiques (par exemple les deux chlorures du 1,2-dichlorocyclopentane) pointent dans la même direction à partir du Plan du cycle, et trans pour distinguer l’isomère où ils pointent dans des directions opposées.
un nom commun pour ces isomères dits « cis-trans” est « isomères géométriques”.,
pour que l’isomérie cis – trans existe dans les cycles, nous avons besoin de deux conditions:
- deux (et seulement deux) carbones portant chacun des substituants non identiques au – dessus et au-dessous du cycle
- Les deux carbones ont au moins un de ces substituants en commun
dans le 1,2-dichlorocyclopentane nous avons vu que C-1 et C-2 avaient chacun des substituants non identiques (H et Cl) au-dessus et au-dessous de l’anneau, et ils avaient chacun au moins un substituant en commun (en fait, ils ont deux substituants en commun: h et CL ).
Voici un autre exemple: cis – et trans– 1-éthyl-2-méthylcyclobutane., Notez qu’ils ont chacun deux carbones qui portent chacun des substituants non identiques au-dessus et au-dessous du cycle (H et CH3; H et CH2CH3). Ils ont également au moins un substituant en commun (H). Nous pouvons donc nous référer au cis-1-éthyl-2-méthylcyclohexane comme isomère où les deux hydrogènes pointent dans la même direction, et au trans où ils pointent dans des directions opposées.
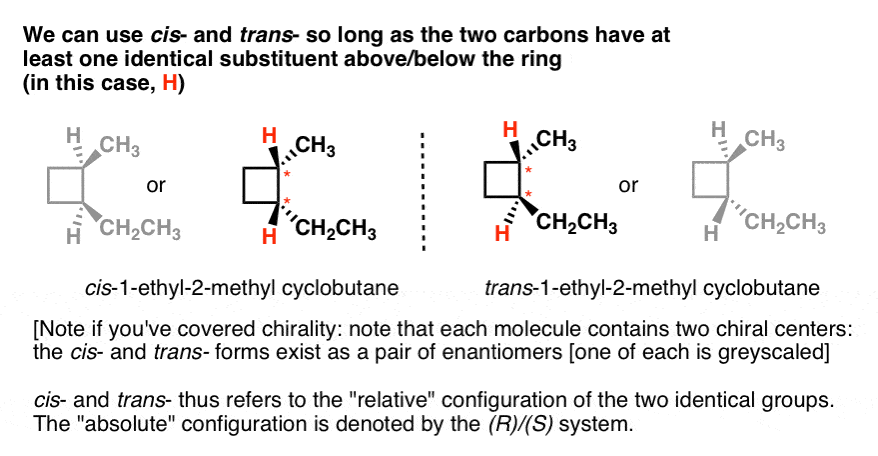
Si vous avez couvert la chiralité, vous pouvez également noter un fait intéressant: il existe deux façons de dessiner chacun des isomères cis et trans, et ils ne peuvent pas être superposés les uns aux autres., Ce sont des énantiomères, par la manière.
donc cis – et trans – ne spécifie pas quel énantiomère (il peut être appliqué à l’un ou l’autre). Il décrit simplement la configuration relative des deux groupes (H dans ce cas). Si nous voulons spécifier un énantiomère particulier, nous devons utiliser le système Cahn-Ingold-Prelog (CIP) d’attribution de configurations R et S, qui nous fournit la configuration « absolue”. Dans ce cas, cis– et trans – est redondant.
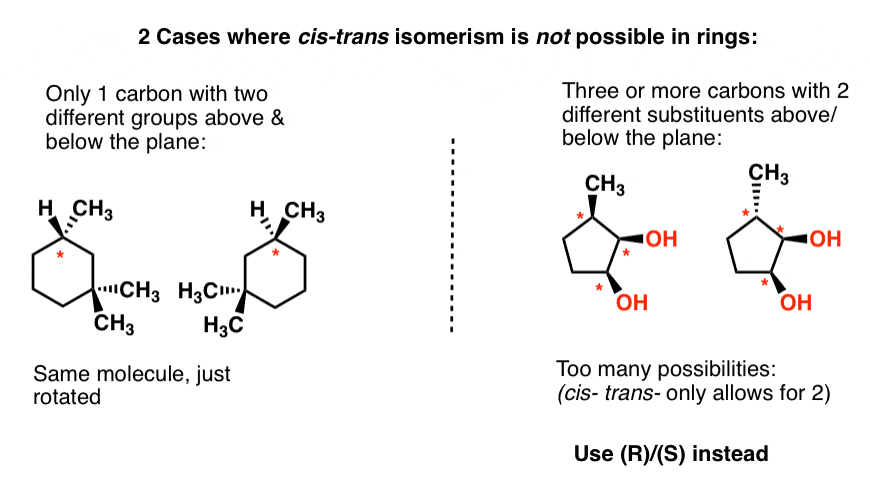
parce que cis– et trans– sont relatifs, cela ne fonctionne pas si les deux carbones ne partagent pas un substituant commun. Dans ce cas, vous devez également utiliser (R) / (S).,
nous prenons trop de temps pour passer par les anneaux ici, alors illustrons simplement 2 exemples où « cis” et trans” ne fonctionnent pas dans les anneaux et laissons-le là.
2. isomérie cis et trans (isomérie géométrique) dans les alcènes
l’isomérie cis-trans est également possible pour les alcènes. Comme dans les petits anneaux, la rotation autour des liaisons pi est également contrainte: en raison du chevauchement « latéral” des liaisons pi, on ne peut pas faire pivoter une liaison pi sans la casser., Cela contraste avec les liaisons sigma classiques (liaisons simples) dans les molécules acycliques, où la rotation libre est possible: témoin 1,2-dichloroéthane (ci-dessous à gauche).
Par conséquent, nous pouvons avoir des molécules telles que le CIS-1,2-dichloroéthène et le trans-1,2-dichloroéthène qui peuvent être séparées les unes des autres en raison de leurs propriétés physiques différentes.
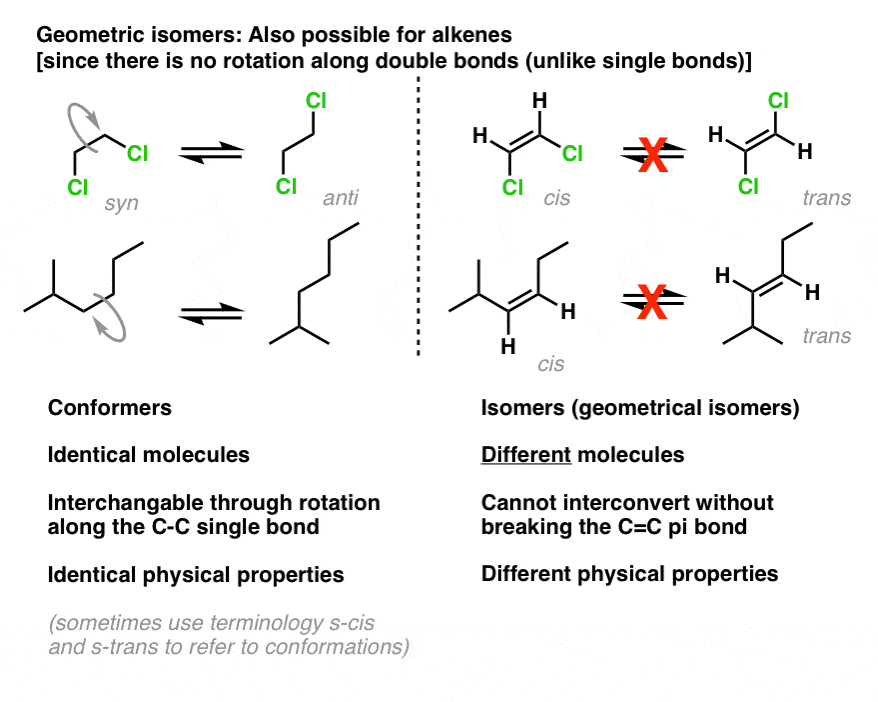
Nous pouvons également utiliser la nomenclature cis–trans pour distinguer les isomères tels que le 2-méthyl-3-hexène (ci-dessus à droite)., Dans l’isomère cis, les deux hydrogènes sont du même côté de la liaison pi, et dans l’isomère trans, les deux hydrogènes sont du côté opposé de la liaison.
comme pour les cycles, l’exigence minimale pour l’isomérie cis-trans dans les alcènes est que chaque carbone soit lié à deux groupes différents, et que les deux carbones aient au moins un substituant en commun.
comme pour les cycles, l’isomérie cis-trans n’est pas possible si l’un des carbones de la double liaison est attaché à deux groupes identiques, comme pour le 1,1-dibromo-1-propène, ci-dessous. Essayez par vous-même si vous n’êtes pas convaincu.,
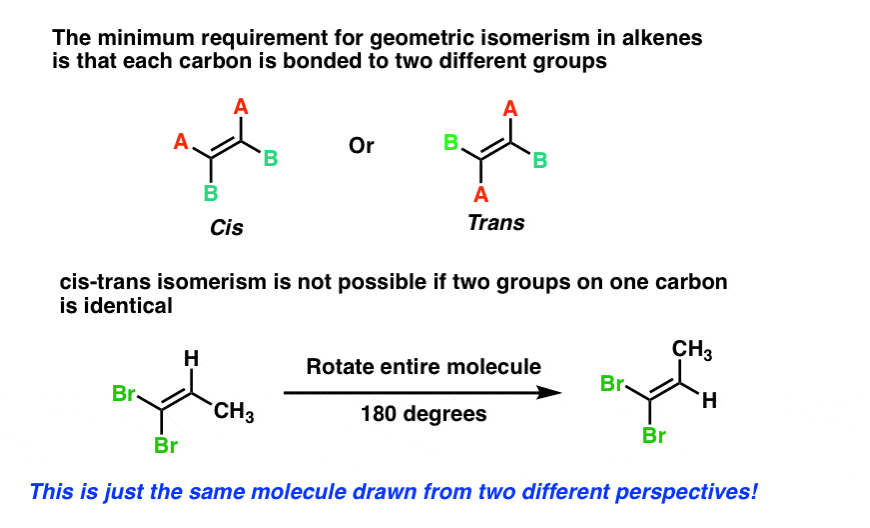
3. Méfiez-vous des noms ambigus où L’isomérie Cis/Trans est Possible
une digression rapide: une conséquence de notre nouvelle appréciation de l’isomérie géométrique est que de nombreux noms de molécules à consonance simple sont en fait Ambigus.
Par exemple, le descripteur « 3-hexène” ne décrit pas sans ambiguïté une molécule spécifique. . Pour clouer la molécule spécifique, nous devons spécifier cis ou trans– 3-hexène.,
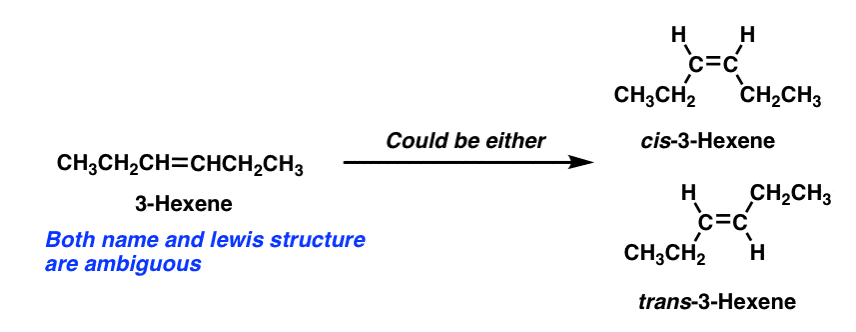
notez que le 1-hexène est toujours correct, car la position 1 du 1-hexène est attachée à deux groupes identiques (hydrogènes) et donc aucun isomère cis-trans n’est possible.
4. L’isomérie Cis-Trans pour les alcènes cycliques
cis – et trans peut également être appliquée aux alcènes dans les cycles. Par exemple, sur le papier, il est possible de dessiner cis– et trans– cyclohexène, car la liaison pi répond aux exigences de l’isomérie cis – trans. En réalité, le trans-cyclohexène est incroyablement tendu. Essayez de vous embrasser sur le coccyx., Cela vous donnera une idée de la souche impliquée dans la tentative d’accueillir une liaison trans– double dans un anneau à six membres .
Pour cette raison, pour les tailles d’anneau 7 et ci-dessous, il est sûr d’ignorer l’écriture « cis” : la configuration est des suppositions.
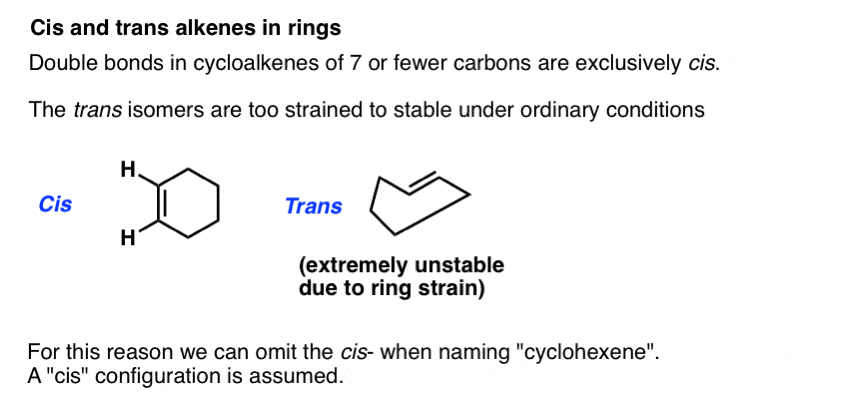
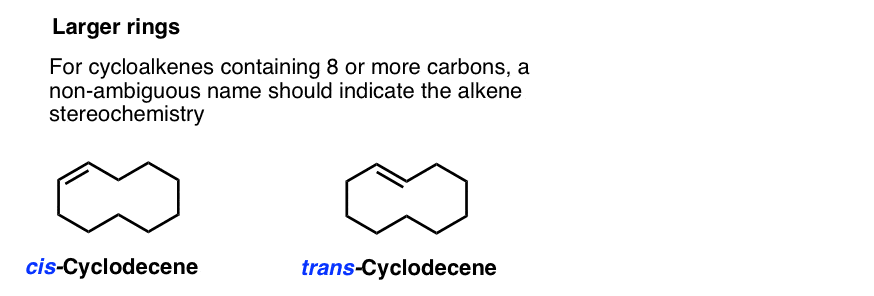
à des tailles d’anneaux de 8 et plus, nous devons mettre un cis– ou trans – dans le nom, car l’isomère trans devient réalisable. (Imaginez essayer de vous embrasser sur le coccyx si vous aviez le cou d’une girafe: soudainement pas impossible!,)
une Solution pour quand « Cis” et « Trans” échouent: le système E/Z
Nous avons vu que cis et trans échouent dans les anneaux quand les deux carbones manquaient d’un substituant commun. Il échoue également pour les alcènes dans ces circonstances.
exemple: essayez d’appliquer cis et trans de l’alcène ci-dessous:
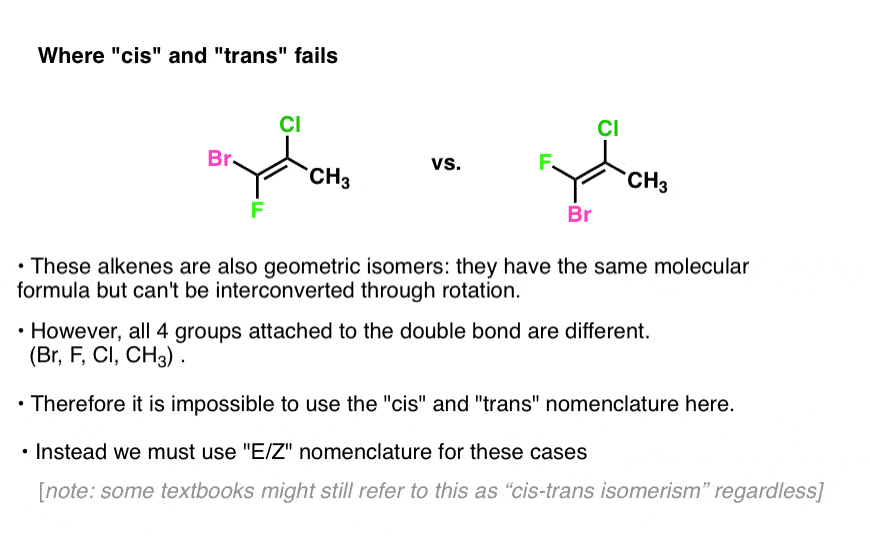
vous Voyez le problème?
En l’absence de deux groupes identiques, nous n’avons pas de point de référence!
à gauche, le chlore est cis à Br et trans à F. mais cela justifie-t-il vraiment d’appeler l’isomère « cis” ? Comment pouvons-nous décider?,
Nous avons besoin d’un moyen de déterminer les priorités dans ces situations.
la Notation E et Z pour les alcènes
heureusement, nous pouvons appliquer le système de classement développé par Cahn, Ingold et Prelog pour les centres chiraux (comme évoqué dans ce post précédent sur la nomenclature (R) / (S)) à cette fin.
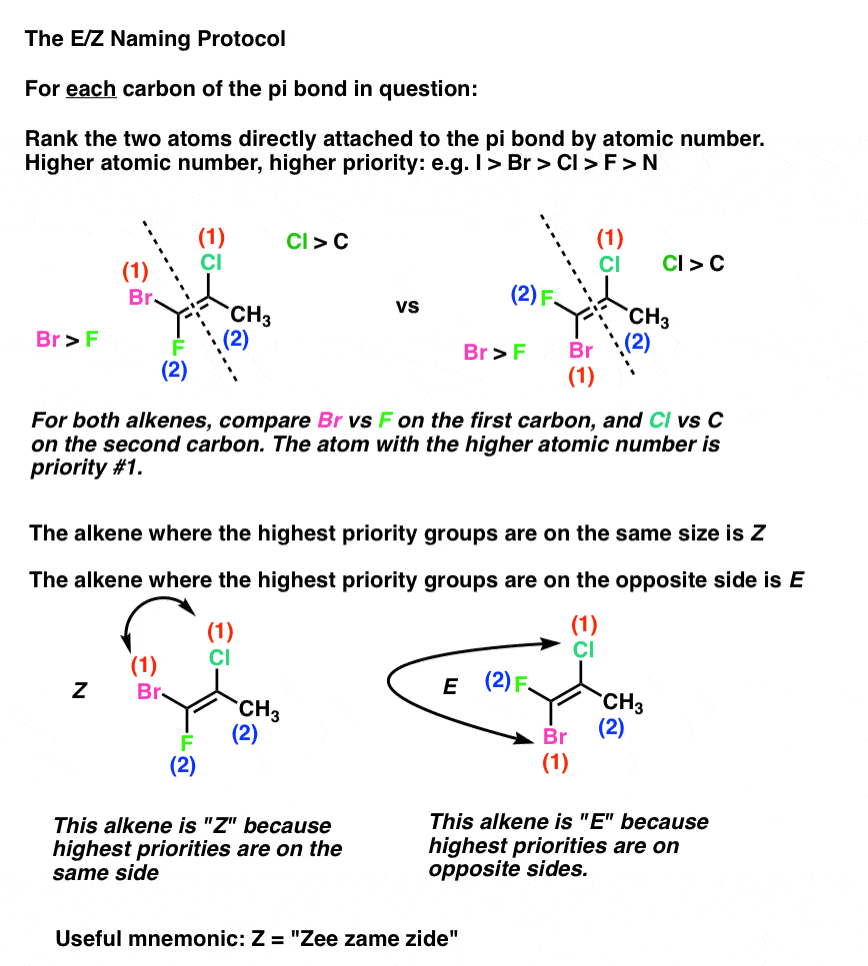
le protocole est le suivant:
- chaque carbone de la liaison pi est attaché à deux substituants. Pour chaque carbone, ces deux substituants sont classés (1 ou 2) en fonction des numéros atomiques de l’atome directement attaché au carbone. (par ex., Cl > F)
- Si les deux substituants Classés 1 sont du même côté de la liaison pi, la liaison reçoit le descripteur Z (abréviation allemande Zusammen, qui signifie”ensemble »).
- Si les deux substituants Classés 1 sont du côté opposé de la liaison pi, la liaison reçoit le descripteur E (abréviation de L’Allemand Entgegen, qui signifie « opposé”).
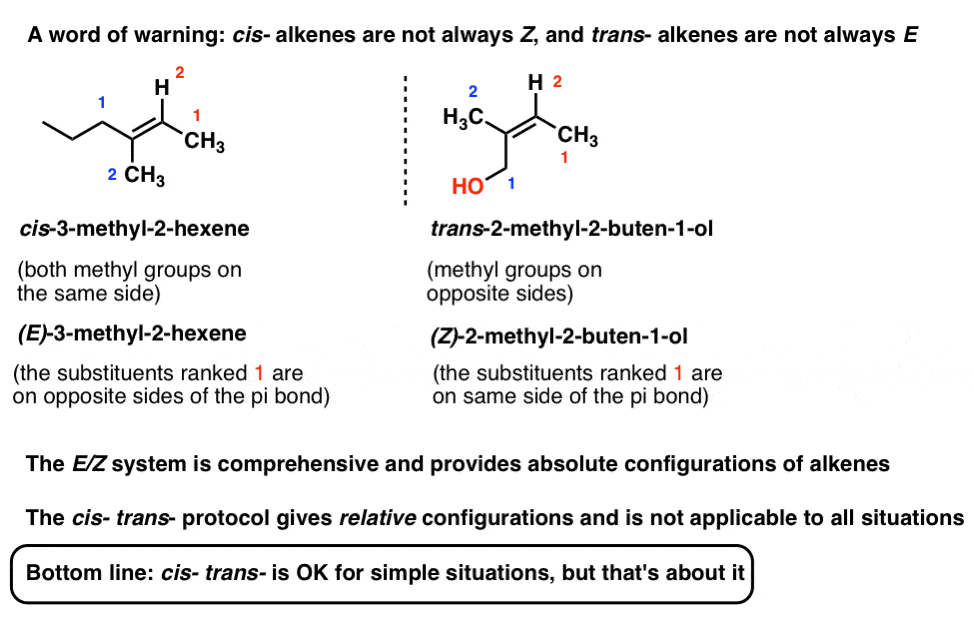
Donc Z ressemble à « cis” et E ressemble à « trans” . (Note: ils ne sont pas nécessairement les mêmes et ne sont pas toujours corrélés: voir la note de bas de page pour un exemple d’alcène cis qui est E., Le système E/Z est complet pour tous les alcènes capables d’isomérisme géométrique, y compris les alcènes cis/trans exemples ci-dessus. Nous utilisons souvent cis / trans pour plus de commodité, mais E/Z est le moyen « officiel” approuvé par L’IUPAC de nommer les stéréoisomères d’alcène].
un moyen facile de se souvenir de Z est de dire « Zee Zame Zide” avec un accent allemand. Ma façon de le faire était de prétendre que le Z signifie « zis”. Tout ce qui fonctionne pour vous.,
Voici un exemple pratique:
comme pour les centres chiraux, le classement en fonction du numéro atomique peut entraîner des liens si nous nous limitons uniquement aux atomes directement attachés aux liaisons pi.
7. Briser les liens: La Méthode des Points
Par exemple, l’alcène ci-dessous nous présente un dilemme: l’un des carbones de l’alcène est attaché à deux atomes de carbone. Alors, comment déterminer les priorités dans ce cas. Comment rompons-nous les liens?
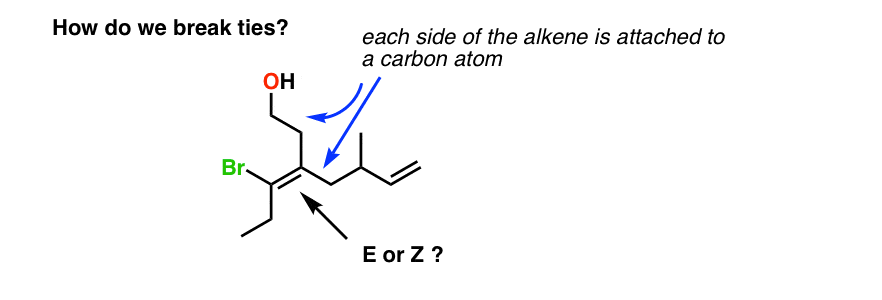
Dans le cas de liens, nous devons appliquer la méthode des points., Les points sont des espaces réservés pratiques, c’est pourquoi j’aime utiliser cette méthode.
- placez un point sur chacun des deux atomes que vous comparez.
- liste les 3 atomes auxquels chaque atome est attaché, par ordre de numéro atomique.
- comparez les listes, un peu comme vous compareriez un ensemble de trois cartes à jouer. Tout comme une main de (8, 8, 7) a battu (8, 7, 7), alors (C, C, H) temps (C, H, H).
- Si les listes sont identiques, déplacez les points vers l’atome de priorité le plus élevé de la liste.
- au premier point de différence, assigner (E ou Z).,
- S’il n’y a pas de différence then alors les groupes sont identiques, et E / Z ne s’applique pas.
Voici un exemple pratique de la « méthode des points”. 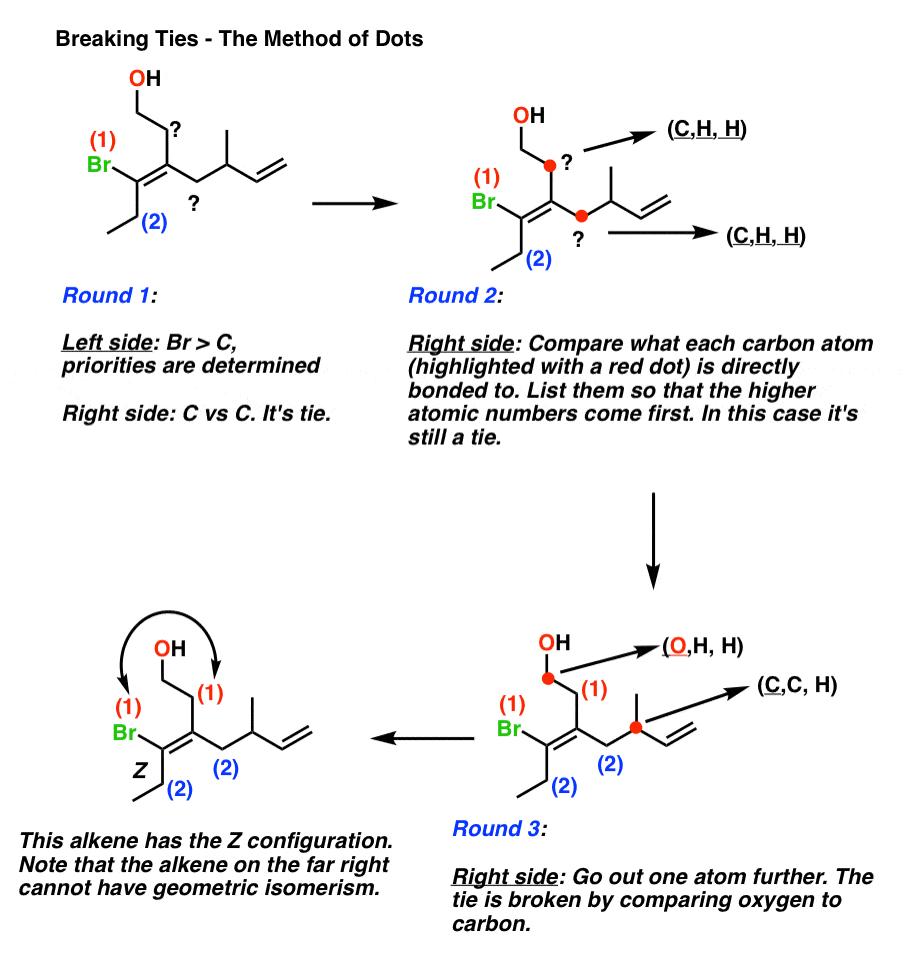
Voici un exemple plus complexe avec plusieurs alcènes. Dans ce cas, chaque liaison pi est désignée par un numéro avec sa propre configuration e ou Z distincte.
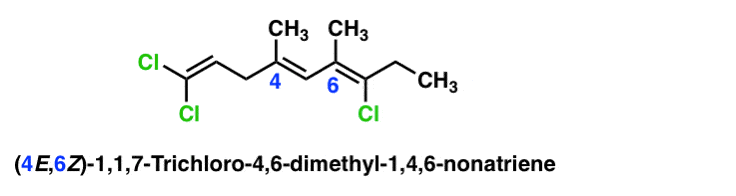
OK, c’était long. Mais je l’espère utile.
attention à un futur article dans lequel nous allons plus en détail sur la « méthode des points”.
8., Conclusion: la Notation E et Z pour les alcènes
cis-trans – est correcte pour décrire les stéréoisomères d’alcènes simples, mais ne fonctionne que dans certains cas. De plus, il ne donne que des configurations relatives. Le système E/Z est complet et décrit la configuration absolue de la molécule.
Voir ci-dessous un exemple d’un alcène E qui est « cis” et D’un alcène Z qui est « trans”.
juste un rappel: ce post a été co-écrit par Matt Pierce de Organic Chemistry Solutions. Demandez à Matt de planifier une session de tutorat en ligne ici.,
Notes
Note 1: Il est possible d’avoir un alcène que nous décririons comme » cis » soit E et vice versa.
E / Z est la nomenclature préférée, plus complète car elle décrit la configuration absolue, alors que cis – trans – décrit simplement la configuration relative.
Note 2: le trans-cyclopropène, le trans-cyclobutène et le trans-cyclopentène n’ont jamais été synthétisés ou observés. trans-cyclohexène est une curiosité de laboratoire, stable, à quelques degrés au dessus du zéro absolu. le trans-cycloheptène a une demi-vie extrêmement courte à température ambiante., trans-cyclooctène est une molécule stable .
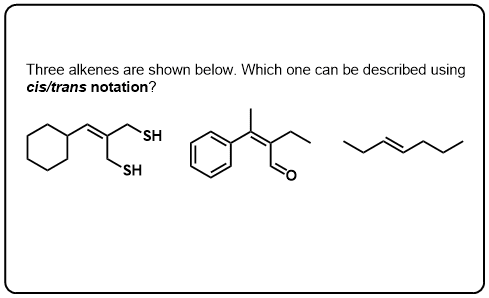
testez-Vous!,v>
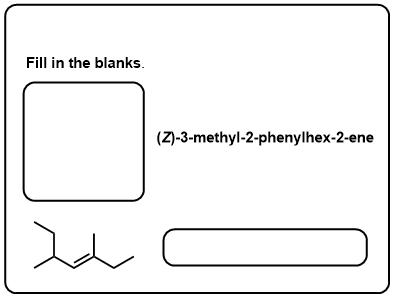 Cliquez pour Flip
Cliquez pour Flip
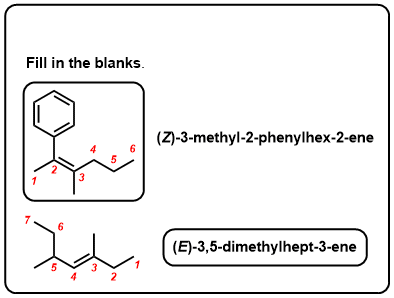
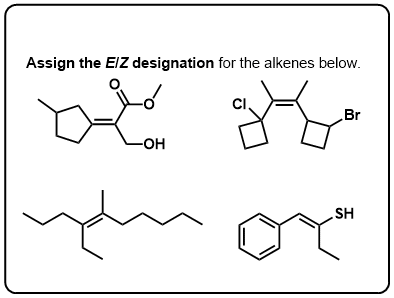 Cliquez pour Flip
Cliquez pour Flip
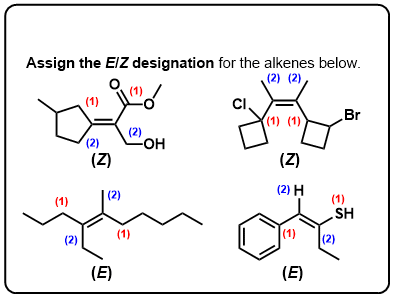
 Cliquez pour Flip
Cliquez pour Flip
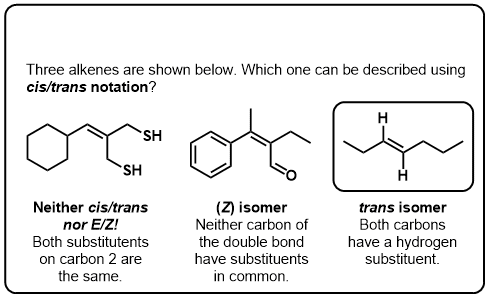
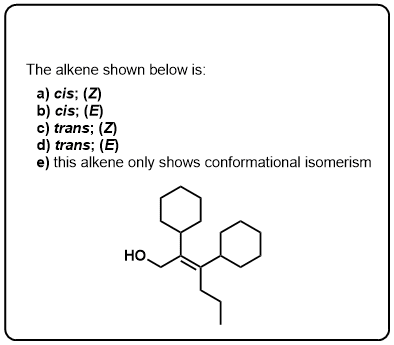 Cliquez pour Flip
Cliquez pour Flip

 Cliquez pour Flip
Cliquez pour Flip 
 Cliquez pour Flip
Cliquez pour Flip 
 Cliquez pour Flip
Cliquez pour Flip 
 Cliquez pour Flip
Cliquez pour Flip 