Introduction
le virus Corona SARS-CoV-2 s’est déjà propagé dans le monde entier et est actuellement, sans vaccin disponible, imparable. Selon aujourd’hui, COVID-19 affecte plus de 3 000 000 de patients confirmés dans le monde. Les médicaments de première intention sont des médicaments antiviraux et plusieurs essais cliniques urgents sont en cours., Cependant, un essai clinique récent testant l’association lopinavir et ritonavir, inhibiteur de la protéase du VIH, n’a montré aucune activité antivirale significative contre le SARS-CoV-2 chez les patients atteints d’une maladie grave (1). Tant que nous n’avons pas de thérapies antivirales spécifiques contre le SARS-CoV-2, nous devons fournir des thérapies symptomatiques de soutien pour prévenir l’insuffisance pulmonaire, la cause la plus fréquente de mortalité liée à la COVID-19.,
les cellules alvéolaires de type II sont endommagées par le SARS-COV-2
l’infection virale et la destruction des cellules alvéolaires qui en résulte attirent les cellules immunitaires avec une réaction inflammatoire alvéolaire exsudative et interstitielle excessive. Une tempête de production de cytokines et de chimiokines entraîne la destruction des tissus pulmonaires et, finalement, le syndrome de détresse respiratoire aiguë sévère (SDRA). Le SARS-CoV – 2 ainsi que le SARS-CoV pénètrent dans les cellules par le récepteur de l’enzyme de conversion de l’angiotensine 2 (ACE2)., L’ACE2 est fortement exprimée sur la surface apicale de l’épithélium des voies respiratoires, de l’endothélie vasculaire, des tissus rénaux et cardiovasculaires ainsi que sur diverses autres cellules (2). Lorsqu’ils pénètrent dans les voies respiratoires, Le SARS-CoV et le SARS-CoV-2 peuvent détruire spécifiquement les cellules, qui expriment principalement le récepteur ACE2 sur leurs surfaces, à savoir les cellules alvéolaires de type II (2, 3).
en tant que cellules progénitrices de l’épithélium alvéolaire, les cellules alvéolaires de type II sont le « défenseur de l’Alvéole” (4)., Ils maintiennent l’homéostasie alvéolaire, en particulier après des lésions pulmonaires microbiennes, où ils contrôlent la réponse inflammatoire.
grâce à leur production du tensioactif pulmonaire Protecteur, les cellules alvéolaires de type II réduisent la tension superficielle pulmonaire et facilitent ainsi la respiration et les échanges gazeux, et sont en outre centrales pour les processus de réparation après traumatisme (5) (Figure 1). Les dommages aux cellules alvéolaires de type II réduisent considérablement la production et la sécrétion de tensioactifs pulmonaires dans l’espace alvéolaire., Ceci est suivi d’une atélectasie due à un dysfonctionnement du surfactant pulmonaire qui réduit encore la compliance pulmonaire (6). L’interphase air-liquide est perturbée chez les patients infectés par le SRAS-CoV-2, ce qui entraîne des lésions pulmonaires. ACE2 lui-même protège des lésions pulmonaires grâce à des mécanismes anti-inflammatoires et anti-fibrotiques. Ainsi, l’utilisation de l’enzyme de conversion de l’angiotensine recombinante (ACE) bloquerait non seulement les sites de liaison aux récepteurs viraux, mais assurerait également une protection pulmonaire. Dans le scénario où SARS-CoV-2 se lie à ACE2, la liaison de protection ACE est sévèrement réduite., La destruction des cellules alvéolaires est suivie d’une diminution de l’oxygénation sanguine, d’une fibrose pulmonaire, d’un œdème, d’une altération de la régénération et, finalement, d’une insuffisance respiratoire (7).
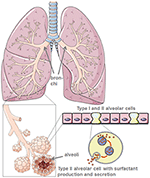
la Figure 1. Modèle de morphologie pulmonaire et alvéolaire. Le surfactant pulmonaire est produit par des cellules alvéolaires de type II. Créé à l’aide de Smart servier medical art soushttps://creativecommons.org/licenses/by/3.0/.,
tensioactif pulmonaire en tant que traitement anti-inflammatoire protecteur du SDRA
l’insuffisance respiratoire est également connue sous une origine entièrement différente, à savoir chez les nourrissons prématurés dont la production de tensioactif pulmonaire est réduite par rapport aux enfants nés à terme. Sans tensioactif pulmonaire suffisant, les alvéoles s’effondrent pendant l’expiration, entraînant une mauvaise oxygénation du sang.
Les surfaces pulmonaires représentent l’interphase Air-Liquide et sont en mouvement constant pendant l’entrée et l’expiration. Ce dernier confère le risque d’effondrement des tissus dû à la tension superficielle du fluide., Le poumon surmonte ce danger en recouvrant sa surface de surfactant pulmonaire. Le tensioactif pulmonaire est produit dans des cellules spécialisées situées dans les branches pulmonaires terminales, les cellules alvéolaires de type II, qui commencent à produire du tensioactif pulmonaire immédiatement après la naissance (8).
le tensioactif pulmonaire est un mélange de phospholipides et de quatre protéines tensioactives (SP), à savoir les hydrophiles SP-A et SP-D, également appelées collectines, et les lipophiles SP-B et SP-C (9). Le tensioactif pulmonaire abaisse la tension superficielle et empêche ainsi l’effondrement alvéolaire pendant l’expiration., Tous les SP contribuent aux réponses immunitaires innées du poumon tandis que les SP-B et SP-C influencent également la consistance du tensioactif riche en phospholipides (10). Récemment, de nouvelles protéines associées aux tensioactifs (SFTA) ont été décrites avec des propriétés similaires à celles de la SP « classique” (11-13). SFTA2 est hydrophile et présente des propriétés similaires à celles de SP-A et SP-D (13). SFTA3 améliore la phagocytose des lignées cellulaires macrophages (14) et est une protéine amphiphile (12)., Par conséquent, il est susceptible d’être présent dans les extractions lipophiles disponibles dans le commerce des poumons d’animaux et pourrait améliorer l’activité phagocytotique des macrophages contre le CoV-2.
chez les prématurés, la production de surfactant pulmonaire est insuffisante avec une mauvaise oxygénation du sang et une tension superficielle alvéolaire élevée entraînant une réaction inflammatoire accrue.
à partir de la fin des années soixante-dix, un surfactant exogène du poumon bovin ou porcin dérivé du lavage bronchique a été établi avec succès comme traitement de la SDRA chez les prématurés., Le traitement avec des préparations de tensioactifs pulmonaires conduit à une oxygénation accrue et à une survie accrue (15-17). Il convient de noter que le traitement par un tensioactif pulmonaire naturel a eu de meilleurs résultats en ce qui concerne la survie du nourrisson que le tensioactif pulmonaire synthétique (17). Les tensioactifs pulmonaires naturels sont un mélange de lipides (90%) et de protéines tensioactives (10%) qui régulent l’activité des macrophages alvéolaires et réduisent l’inflammation. La fraction de tensioactif pulmonaire lipophile présente des propriétés anti-inflammatoires lorsqu’elle est appliquée par voie intratrachéale sur le poumon (18) ainsi que par voie topique sur la peau (19)., Dans la peau, le tensioactif pulmonaire réduit l’expression des gènes pro-inflammatoires et pro-fibrotiques dans les plaies in vivo. Dans divers modèles in vitro et in vivo murins et humains d’inflammation des plaies, le tensioactif pulmonaire a réduit le TNF-α, LE TACE et l’IL-6 (19), qui sont très élevés chez les patients gravement atteints de COVID-19.
des découvertes récentes montrent que le SARS-CoV-2 induit la destruction des cellules alvéolaires de type II dans la pneumonie associée au COVID-19 (2). Exactement ces cellules produisent du surfactant pulmonaire et empêchent l’effondrement pulmonaire., En outre, la lymphocytopénie avec libération massive de cytokines est un autre facteur conduisant à une insuffisance pulmonaire et à la mort dans les cas graves de patients COVID-19. Par conséquent, des cibles anti-inflammatoires telles que l’anti-TNF et l’anti-IL-6 ont été suggérées pour mieux contrôler l’infection sévère COVID-19 (20).,
Discussion: L’utilisation de Surfactant pulmonaire pour la restauration de la barrière pulmonaire chez les patients atteints de pneumonie COVID-19
bien que le traitement par surfactant pulmonaire soit le traitement standard, très sûr et efficace pour les nouveau-nés atteints de SDRA, le traitement par surfactant recombinant à base de SP-C n’a pas montré d’amélioration de la survie dans les principaux essais contrôlés randomisés chez les adultes (18). Fait important, l’utilisation de tensioactifs naturels semble être avantageuse par rapport aux tensioactifs synthétiques (16, 17) avec une amélioration significative de l’oxygénation du sang et un temps de ventilation plus court chez les nourrissons (16)., Le syndrome d’aspiration méconium ressemble à une pneumonie COVID-19 avec une production réduite de tensioactifs et une destruction des cellules alvéolaires de type II (21). L’administration précoce de surfactant pulmonaire naturel a diminué le traitement par ECMO et le temps de ventilation (21). Cela suggère que l’administration précoce de surfactant pulmonaire naturel pourrait en effet améliorer la fonction pulmonaire également chez les patients adultes atteints de SDRA sévère, alors que la cause du décès peut ne pas être le poumon effondré seul, mais plutôt une défaillance multi-organe., En outre, différents facteurs de risque pour le développement de SDRA et différents phénotypes impliquent des effets variables possibles en raison de mesures thérapeutiques. Ainsi, des effets bénéfiques du traitement par tensioactif chez les patients atteints de SDRA associés au COVID-19 sont envisageables, en particulier lorsqu’ils sont appliqués tôt dans la stratégie de traitement contre l’insuffisance pulmonaire.,
en raison de l’efficacité anti-inflammatoire et de protection pulmonaire robuste et du besoin urgent d’une thérapie de soutien pulmonaire, nous proposons le traitement adjuvant des patients atteints de pneumonie COVID-19 en USI avec des tensioactifs pulmonaires naturels en plus du traitement de soins intensifs ARDS standard actuel. Les preuves actuelles suggèrent que cela augmenterait l’oxygénation du sang, réduirait l’œdème pulmonaire et améliorerait la réaction inflammatoire excessive trouvée dans les autopsies pulmonaires de patients COVID-19 (22)., Windtree therapeutics™ a annoncé son intention de tester KL4, un tensioactif synthétique, chez des patients infectés par le COVID-19 sévère (https://www.windtreetx.com/). En Allemagne, Lyomark Pharma GmbH prévoit de tester son tensioactif pulmonaire naturel à plusieurs composants bovactant chez des patients adultes atteints de covid-19 atteints de pneumonie (www.lyomark.com
le surfactant pulmonaire disponible dans le commerce est relativement peu coûteux pour les normes de L’USI, facilement disponible et n’a aucun effet secondaire connu chez les enfants et les adultes., Des précautions doivent être prises chez les patients présentant des allergies connues aux produits bovins ou porcins, car les tensioactifs pulmonaires sont principalement prélevés sur les poumons de bovins (bovactant, Alveofact®) ou porcins (poractant alfa, Curosurf®) par lavage ou hachage des tissus suivi d’une extraction de la fraction lipidique.
L’Administration est simple en ajoutant le lyophilisat reconstitué dans le tube trachéal du patient ventilé délivrant le médicament directement dans l’espace alvéolaire. En ce qui concerne bovactant, un nébuliseur a récemment été approuvé pour une utilisation clinique aux États-Unis par la FDA., En recouvrant la surface externe des alvéoles, le tensioactif pulmonaire agit directement sur les cellules inflammatoires en réduisant la production de cytokines et la destruction des tissus. Ainsi, il restaure la barrière pulmonaire et empêche ainsi l’effondrement pulmonaire (Figure 2). Par conséquent, il réduira la durée de la thérapie de ventilation, facilitera la respiration et contribuera ainsi à la récupération des patients.
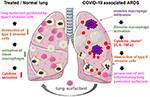
la Figure 2. Mécanisme hypothétique de l’extérieur appliqué surfactant pulmonaire pulmonaire protection de graves COVID-19 associés SDRA., La SDRA associée au COVID-19 se caractérise par une infiltration massive de macrophages, une activation des macrophages alvéolaires tissulaires et une potentialisation de la production de cytokines dans le poumon (cytokine « storm”), ce qui conduit à la destruction des cellules alvéolaires de type II produisant des tensioactifs, ce qui aggrave la situation par la perte de tensioactif pulmonaire anti-inflammatoire et anti-fibrotique. Le tensioactif exogène peut réduire l’inflammation et ainsi restaurer la survie pulmonaire. Créé à l’aide de Smart servier medical art soushttps://creativecommons.org/licenses/by/3.0/.,
les Contributions d’Auteur
Tous les auteurs ont contribué à la conception, la rédaction et de la conceptualisation du manuscrit. UM et KM ont édité et conçu les figures.
conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à remercier Desiree Schumann (Université de Bâle) pour son soutien perspicace dans la rédaction de ce manuscrit., Les auteurs sont soutenus par la Fondation allemande pour la recherche (DFG) et JDRF. Nous tenons à nous excuser de ne pas citer de nombreuses publications importantes en raison des limitations d’espace.
9. Bernhard W. tensioactif pulmonaire: fonction et composition dans le contexte du développement et de la physiologie respiratoire. Ann Anat. (2016) 208:146–50. doi: 10.1016/j.aanat.2016.08.003
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
10. Wright JR., La « sagesse » du surfactant pulmonaire: équilibrer la défense de l’hôte et les fonctions de réduction de la tension superficielle. Am J Physiol Cellule Pulmonaire Mol Physiol. (2006) 291: L847–50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et coll. Sfta3-une nouvelle protéine tensioactive de la surface oculaire et son rôle dans la cicatrisation des plaies cornéennes et la tension superficielle du film lacrymal. Sci La République (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Surfactant thérapie chez les nourrissons prématurés avec le syndrome de détresse respiratoire et à court terme ou de nouveau-nés à terme aiguë RDS. J Périnatol. (2006) 26 (Suppl. 1): S51-6; discussion S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
16. Été JV, Zimmermann LJ. Quoi de neuf en surfactant? D’un point de vue clinique, de l’évolution récente de la néonatologie et la pédiatrie. Europ J Pédiatrie. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC,et al. Pumactant et poractant alfa pour le traitement du syndrome de détresse respiratoire chez les nouveau-nés nés à 25 à 29 semaines de gestation: un essai randomisé. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar