Chimie Unique des éléments les plus légers
la chimie de l’élément de deuxième période de chaque groupe (n = 2: Li, Be, B, C, N, O et F) diffère à bien des égards importants de celle des membres plus lourds, ou congénères, du groupe. Par conséquent, les éléments de la troisième période ( N = 3: Na, Mg, Al, Si, P, S et Cl) sont généralement plus représentatifs du groupe auquel ils appartiennent., La chimie anormale des éléments de deuxième période résulte de trois caractéristiques importantes: de petits rayons, des orbitales d énergétiquement indisponibles et une tendance à former des liaisons pi (π) avec d’autres atomes.
contrairement à la chimie des éléments de deuxième période, la chimie des éléments de troisième période est plus représentative de la chimie du groupe respectif.
en raison de leurs petits rayons, les éléments de deuxième période ont des affinités électroniques moins négatives que ce qui serait prédit par les tendances périodiques générales., Lorsqu’un électron est ajouté à un atome aussi petit, une augmentation des répulsions électron–électron a tendance à déstabiliser l’anion. De plus, les petites tailles de ces éléments les empêchent de former des composés dans lesquels ils ont plus de quatre voisins les plus proches. Ainsi BF3 ne forme que l’ion BF4 tétraédrique à quatre coordonnées, alors que dans les mêmes conditions AlF3 forme l’ion AlF63 octaédrique à six coordonnées. En raison de la taille atomique plus petite, les composés ioniques binaires simples des éléments de deuxième période ont également un caractère plus covalent que les composés correspondants formés à partir de leurs congénères plus lourds., Les très petits cations dérivés des éléments de deuxième période ont un rapport charge / rayon élevé et peuvent donc polariser la coquille de valence remplie d’un anion. A ce titre, la liaison dans de tels composés présente une composante covalente importante, conférant aux composés des propriétés qui peuvent différer significativement de celles attendues pour des composés ioniques simples. À titre d’exemple, le LiCl, qui a un caractère partiellement covalent, est beaucoup plus soluble que le NaCl dans les solvants ayant une constante diélectrique relativement faible, comme l’éthanol (ε = 25,3 contre 80,1 pour H2O).,
étant donné que les orbitales d ne sont jamais occupées pour les nombres quantiques principaux inférieurs à 3, les électrons de valence des éléments de seconde période n’occupent que les orbitales 2s et 2p. L’énergie des orbitales 3d dépasse de loin l’énergie des orbitales 2s et 2p, donc leur utilisation dans la liaison est énergétiquement prohibitive. Par conséquent, les configurations d’électrons avec plus de quatre paires d’électrons autour d’un élément central de deuxième période ne sont tout simplement pas observées. Vous vous souvenez peut-être que le rôle des orbitales d dans la liaison dans les composés du groupe principal avec des nombres de coordination de 5 ou plus reste quelque peu controversé., En effet, des descriptions théoriques de la liaison dans des molécules telles que le SF6 ont été publiées sans mentionner la participation des orbitales d sur le soufre. Des Arguments basés sur la disponibilité de l’orbitale d et sur la petite taille de l’atome central prédisent cependant que les nombres de coordination supérieurs à 4 sont inhabituels pour les éléments de la deuxième période, ce qui est en accord avec les résultats expérimentaux.,
l’une des différences les plus spectaculaires entre les éléments du groupe principal les plus légers et leurs congénères plus lourds est la tendance des éléments de la deuxième période à former des espèces qui contiennent des liaisons multiples. Par exemple, N est juste au–dessus de P dans le groupe 15: N2 contient une liaison N≡N, mais chaque atome de phosphore dans le tétraédrique P4 forme trois liaisons P-P. Cette différence de comportement reflète le fait que dans le même groupe du tableau périodique, les énergies relatives de la liaison π et de la liaison sigma (σ) diffèrent. Une liaison C=C, par exemple, est environ 80% plus forte qu’une liaison C–C., En revanche, une liaison Si=Si, avec moins de chevauchement Orbital p entre les orbitales de valence des atomes liés en raison de la plus grande taille atomique, n’est qu’environ 40% plus forte qu’une liaison Si–Si. Par conséquent, les composés qui contiennent à la fois des liaisons C à C multiples et simples sont communs pour le carbone, mais les composés qui ne contiennent que des liaisons sigma si–Si sont plus énergétiquement favorables pour le silicium et les autres éléments de troisième période.,
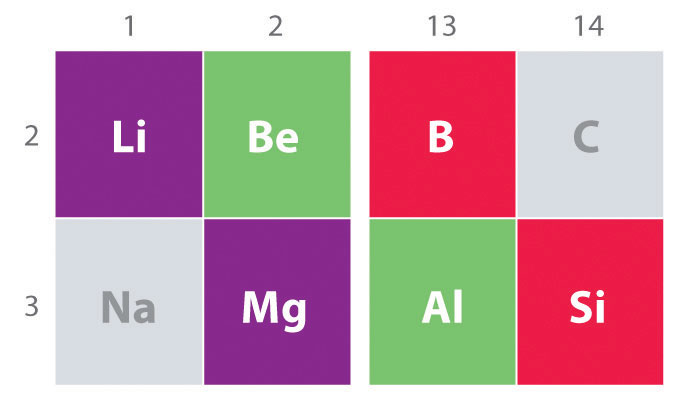
Une autre tendance importante à noter dans la chimie du groupe principal est la similitude chimique entre l’élément le plus léger d’un groupe et l’élément immédiatement en dessous et à droite de celui-ci dans le groupe suivant, un phénomène connu sous le nom d’effet diagonal (Figure \(\PageIndex{2}\)) Il y a, par exemple, des similitudes significatives entre la chimie de Li et Mg, Be Et Al, et B et Si. BeCl2 et AlCl3 ont tous deux un caractère covalent important, de sorte qu’ils sont quelque peu solubles dans les solvants organiques non polaires., En revanche, bien que Mg et Be soient dans le même groupe, MgCl2 se comporte comme un halogénure ionique typique en raison de l’électronégativité inférieure et de la plus grande taille de magnésium.