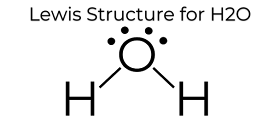
skapad av MakeTheBrainHappy.
H2o Lewis Dot struktur ger det många unika egenskaper främst på grund av de två ensamma paren på den centrala syreatomen. Detta ökar elektronelektronavstötningen och skapar därför en böjd struktur i motsats till CO2: s linjära struktur. Denna ”böjda” molekylära struktur ger den många unika egenskaper som att vara polär., Ett av de mest fascinerande fenomenen är tanken på” vätebindning ” som påverkar vattenets egenskaper dramatiskt.
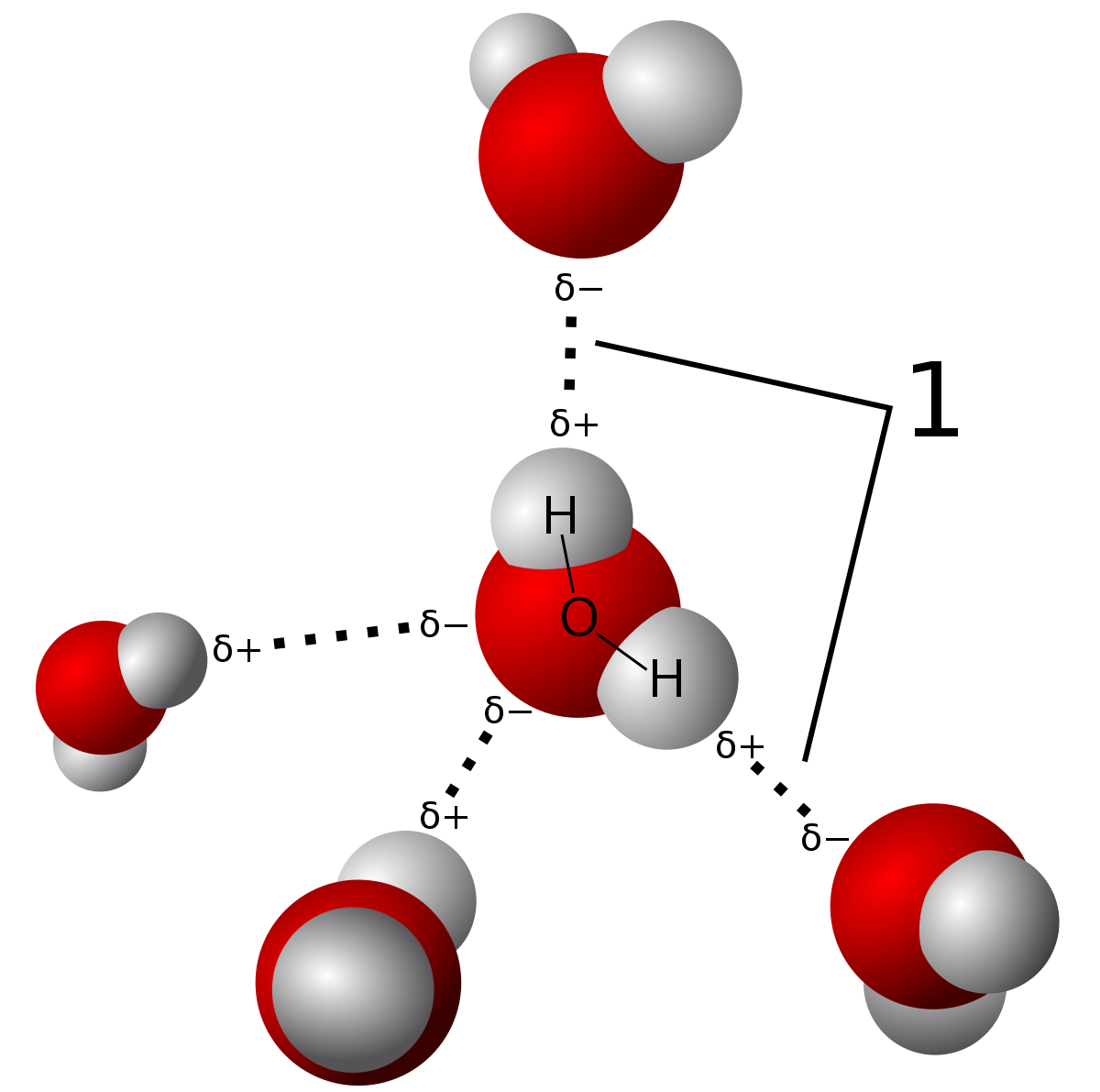
vätebindning är en typ av intermolekylär kraft där elektronegativitetsskillnaden i syreatomen gör att en partiell permanent dipol bildas mellan väte-och syreatomerna (visas i de streckade linjerna). Bindningarna i vattenmolekylen själva är kovalenta bindningar. Du kan lära dig om skillnaden i det här inlägget., Källa
på grund av styrkan hos dessa vätebindningar har vatten en relativt hög smältpunkt och kokpunkt, även om de inte är lika höga som nätverkskovalenta fasta ämnen. De är bundna av intramolekylära krafter som innebär faktisk delning av elektroner vs. partiella dipolkrafter i vätebindningar. Det finns bara tre typer av bindningar som kan väte bindning. Dessa är N-H, O-H och F-H-bindningar på grund av de stora elektronegativitetsskillnaderna mellan molekylerna.,
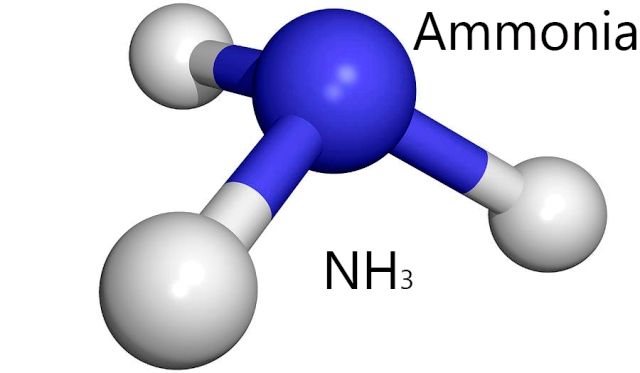
NH3 är en annan molekyl som skapar liknande vätebindningar som H2o. Source
vilka andra egenskaper har vatten?
vatten är ett av de enda element som finns i alla tre tillstånd (fast, flytande och gasformigt) naturligt på jorden. Vätebindning orsakar en kristallin struktur som gör den mindre tät än flytande vatten. Det är därför is flyter i haven. Vatten har också en hög ytspänning och vidhäftning., Sammanhållning och vidhäftning är nödvändiga för växter som manipulerar dessa processer för att flytta vatten från rötterna till bladen för att stödja växtens tillväxt. Allt detta orsakas av den enkla strukturen av H2O, representerad av Lewis Dot-diagrammet ovan.

vattenmolekyler i alla tre materiens tillstånd. Källa