Introducere
Corona virus SARS-CoV-2 s-a răspândit deja în toată lumea, și este în prezent, cu nici un vaccin disponibil încă, de neoprit. În prezent, COVID-19 afectează peste 3,000,000 de pacienți confirmați La nivel global. Medicamentele de primă linie sunt medicamente antivirale și sunt în curs de desfășurare mai multe studii clinice urgente., Cu toate acestea, un studiu clinic recent care a testat asocierea inhibitorului de protează HIV lopinavir și ritonavir nu a demonstrat o activitate antivirală semnificativă împotriva SARS-CoV-2 la pacienții cu boală severă (1). Atâta timp cât nu avem terapii antivirale specifice împotriva SARS-CoV-2, trebuie să oferim terapii simptomatice de susținere pentru a preveni insuficiența pulmonară, cea mai frecventă cauză a mortalității COVID-19.,
celulele alveolare de tip II sunt deteriorate de SARS-COV-2
infecția virală și distrugerea celulară alveolară rezultată atrag celulele imune cu o reacție inflamatorie exudativă alveolară excesivă și interstițială. O furtună de producție de citokine și chemokine are ca rezultat distrugerea țesutului pulmonar și, în cele din urmă, în sindromul de detresă respiratorie acută severă (ARDS). SARS-CoV – 2, precum și SARS-COV intră în celule prin receptorul enzimei de conversie a angiotensinei 2 (ACE2)., ACE2 este puternic exprimat pe suprafața apicală a epiteliilor căilor respiratorii, a endoteliei vasculare, a țesutului renal și cardiovascular, precum și a diferitelor alte celule (2). Pe măsură ce intră prin tractul respirator, SARS-CoV și SARS-COV-2 pot distruge în mod specific celulele, care exprimă predominant receptorul ACE2 pe suprafețele lor, și anume celulele alveolare de tip II (2, 3).ca celule progenitoare pentru epiteliul alveolar, celulele alveolare de tip II sunt „apărătorul alveolului” (4)., Ei mențin homeostazia alveolară, în special după afectarea pulmonară microbiană, unde controlează răspunsul inflamator.prin producerea surfactantului pulmonar protector, celulele alveolare de tip II reduc tensiunea superficială pulmonară și astfel facilitează respirația și schimbul de gaze și, în plus, sunt centrale pentru procesele de reparare după traumatism (5) (Figura 1). Deteriorarea celulelor alveolare de tip II reduce drastic producția și secreția de surfactant pulmonar în spațiul alveolar., Aceasta este urmată de atelectază datorată disfuncției surfactantului pulmonar care reduce și mai mult complianța pulmonară (6). Interfaza aer-lichid este perturbată la pacienții infectați cu SARS-CoV-2, ceea ce duce la leziuni pulmonare. ACE2 în sine protejează împotriva leziunilor pulmonare, deși mecanismele antiinflamatorii și anti-fibrotice. Astfel, utilizarea enzimei de conversie a angiotensinei recombinante (ACE) nu numai că ar bloca situsurile de legare a receptorilor de virus, dar ar oferi și protecție pulmonară. În scenariul în care SARS-CoV-2 se leagă de ACE2, legarea ACE protectoare este redusă sever., Distrugerea celulelor alveolare este urmată de oxigenarea redusă a sângelui, fibroza pulmonară, edeme, regenerarea afectată și, în cele din urmă, duce la insuficiență respiratorie (7).
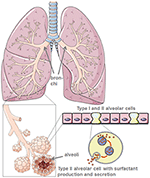
Figura 1. Model de morfologie pulmonară și alveolară. Agentul tensioactiv pulmonar este produs de celulele alveolare de tip II. Creat folosind smart servier medical art sub https://creativecommons.org/licenses/by/3.0/.,
surfactantul pulmonar ca terapie protectoare anti-inflamatoare ARDS
insuficiența respiratorie este, de asemenea, cunoscută de la o origine complet diferită, și anume la sugarii prematuri cu producție redusă de surfactant pulmonar comparativ cu copiii născuți la termen. Fără un surfactant pulmonar suficient, alveolele se prăbușesc în timpul expirării, ducând la o oxigenare slabă a sângelui.suprafețele pulmonare descriu interfaza aer-lichid și sunt în mișcare constantă în timpul în-și expirație. Acesta din urmă conferă riscul de colaps tisular din cauza tensiunii superficiale a fluidului., Plămânul depășește acest pericol prin acoperirea suprafeței sale cu surfactant pulmonar. Surfactantul pulmonar este produs în celule specializate găsite în ramurile pulmonare terminale, celule alveolare de tip II, care încep să producă surfactant pulmonar imediat după naștere (8).agentul tensioactiv pulmonar este un amestec de fosfolipide și patru proteine surfactante (SP), și anume SP-A și SP-D hidrofile, numite și colectine, și SP-B lipofile și SP-C (9). Agentul tensioactiv pulmonar scade tensiunea superficială și astfel previne colapsul alveolar în timpul expirării., Toate SP contribuie la răspunsurile imune înnăscute ale plămânului, în timp ce SP-B și SP-C influențează consistența surfactantului bogat în fosfolipide (10). Recent, proteinele noi asociate surfactantului (SFTA) au fost descrise cu proprietăți similare în comparație cu SP „clasic” (11-13). SFTA2 este hidrofil și prezintă proprietăți similare în comparație cu SP-A și SP-D (13). SFTA3 îmbunătățește fagocitoza liniilor celulare macrofage (14) și este o proteină amfifilă (12)., Prin urmare, este probabil să fie prezent în extracții lipofile disponibile în comerț de plămâni animale și ar putea spori activitatea fagocitotică a macrofagelor împotriva CoV-2.la sugarii prematuri, producția de surfactant pulmonar este insuficientă, cu o oxigenare slabă a sângelui și o tensiune superficială alveolară ridicată, ceea ce duce la creșterea reacției inflamatorii.începând cu sfârșitul anilor șaptezeci, agentul tensioactiv pulmonar exogen bovin sau porcin derivat din lavajul bronșic a fost stabilit cu succes ca terapie pentru ARDS la sugarii prematuri., Tratamentul cu preparate surfactante pulmonare duce la o oxigenare sporită și o supraviețuire crescută (15-17). De remarcat, tratamentul cu surfactant pulmonar natural a avut un rezultat mai bun în ceea ce privește supraviețuirea sugarului în comparație cu surfactantul pulmonar sintetic (17). Surfactanții naturali pulmonari sunt un amestec de lipide (90%) și proteine surfactante (10%) care reglează activitatea macrofagelor alveolare și reduc inflamația. Fracțiunea de surfactant pulmonar lipofil are proprietăți antiinflamatorii atunci când este aplicată intratraheal pe plămân (18), precum și local pe piele (19)., În piele, agentul tensioactiv pulmonar reduce expresia genelor pro-inflamatorii și pro-fibrotice în răni in vivo. În diferite modele murine și umane in vitro și in vivo de inflamație a plăgii, surfactantul pulmonar a redus TNF-α, TACE și IL-6 (19), care sunt foarte crescute la pacienții cu COVID-19 grav afectați.rezultatele recente arată că SARS-CoV-2 induce distrugerea celulelor alveolare de tip II în pneumonia asociată COVID-19 (2). Exact acele celule produc surfactant pulmonar și previn colapsul pulmonar., Mai mult, limfocitopenia cu eliberare masivă de citokine este un alt factor care duce la insuficiență pulmonară și deces în cazurile severe de pacienți cu COVID-19. Prin urmare, s-au sugerat ținte antiinflamatorii, cum ar fi anti-TNF și anti-IL-6, pentru a controla mai bine infecția severă cu COVID-19 (20).,
Discuție: Utilizarea de Surfactant Pulmonar Pulmonară Bariera de Restaurare la Pacienții Cu COVID-19 Pneumonie
Deși surfactant pulmonar terapia standard, foarte sigur si eficient tratament pentru nou-născuți cu ARDS, tratamentul cu recombinant SP-C pe surfactant nu arată îmbunătățit supraviețuirea în marile studii clinice randomizate controlate la adulți (18). Foarte important, utilizarea agenților tensioactivi naturali pare a fi avantajoasă în comparație cu agenții tensioactivi sintetici (16, 17), cu o îmbunătățire semnificativă a oxigenării sângelui și a timpului de ventilație mai scurt la sugari (16)., Sindromul de aspirație Meconium seamănă cu pneumonia COVID-19 cu producția redusă de surfactanți și distrugerea celulelor alveolare de tip II (21). Administrarea precoce a surfactantului pulmonar natural a scăzut terapia ECMO și timpul de ventilație (21). Acest lucru sugerează că administrarea precoce a surfactantului pulmonar natural ar putea îmbunătăți într-adevăr funcția pulmonară și la pacienții adulți cu ARDS severe, în timp ce cauza decesului nu poate fi singur plămânul prăbușit, ci mai degrabă o insuficiență multi-organ., În plus, diferiți factori de risc pentru dezvoltarea ARDS și fenotipuri diferite implică posibile efecte diferite datorită măsurilor terapeutice. Astfel, efectele benefice ale terapiei cu surfactanți la pacienții cu ARDS asociați cu COVID-19 sunt imaginabile, mai ales atunci când sunt aplicate la începutul strategiei de tratament împotriva insuficienței pulmonare.,
din Cauza robust anti-inflamatorii și pulmonar eficacitate de protecție și astăzi este nevoie urgentă de pulmonar terapia de susținere, ne propunem tratamentul adjuvant al COVID-19 pneumonie pacienți pe ICUs naturale pulmonar tensioactivi în plus față de standardul actual de SCDA tratament de terapie intensiva. Dovezile actuale sugerează că acest lucru ar crește oxigenarea sângelui, ar reduce edemul pulmonar și ar ameliora reacția inflamatorie excesivă Găsită în autopsiile pulmonare ale pacienților COVID-19 (22)., Windtree terapeutica™ a anunțat planul lor de a testa KL4, un surfactant sintetic, în severă COVID-19 pacienți infectați (https://www.windtreetx.com/). În Germania, Lyomark Pharma GmbH sunt de planificare pentru a testa lor natural multicomponent surfactant pulmonar bovactant în adult COVID-19 pacienți cu pneumonie, precum și (www.lyomark.com).
disponibil Comercial surfactant pulmonar este relativ ieftin pentru terapie INTENSIVĂ standarde, ușor accesibile și nu are efecte secundare cunoscute la copii și adulți., Trebuie luate măsuri de precauție la pacienții cu alergii cunoscute împotriva bovine sau porcine produse, cum pulmonar tensioactivi sunt cu cea mai mare recoltate de la bovine (bovactant, Alveofact®) sau porcină (poractant alfa, Camion®) plămâni prin lavaj sau de țesut de tocat urmată de extracția lipidelor fracțiune.administrarea este simplă prin adăugarea liofilizatului reconstituit în tubul traheal al pacientului ventilat care eliberează medicamentul direct în spațiul alveolar. În ceea ce privește bovactant, un nebulizator a fost recent aprobat pentru utilizare clinică în SUA de către FDA., Prin acoperirea suprafeței exterioare a alveolelor, agentul tensioactiv pulmonar acționează direct asupra celulelor inflamatorii reducând producția de citokine și distrugerea țesuturilor. Astfel, restabilește bariera pulmonară și astfel previne colapsul pulmonar (Figura 2). În consecință, va reduce durata terapiei ventilatorii, va facilita respirația și, astfel, va contribui la recuperarea pacienților.
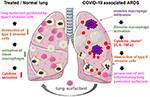
Figura 2. Mecanism ipotetic al surfactantului pulmonar aplicat extern pentru protecția pulmonară în ARDS severe asociate COVID-19., COVID-19 asociate SDRA este caracterizată de masive infiltrarea macrofage, țesutul alveolar de activare macrofagică și o potențare a producerii de citokine în plămân (citokine „furtuna”), ceea ce duce la distrugerea surfactantului producerea de celulele alveolare de tip II, care agravează situația prin pierderea de anti-inflamatorii, anti-fibrotic surfactant pulmonar. Surfactantul exogen poate reduce inflamația și astfel poate restabili supraviețuirea pulmonară. Creat folosind smart servier medical art sub https://creativecommons.org/licenses/by/3.0/.,
contribuții ale autorului
toți autorii au contribuit la proiectarea, scrierea și conceptualizarea manuscrisului. UM și KM editat și proiectat cifrele.
Conflict de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.dorim să mulțumim Desiree Schumann (Universitatea din Basel) pentru sprijinul său perspicace în scrierea acestui manuscris., Autorii sunt susținuți de Fundația Germană de cercetare (DFG) și JDRF. Dorim să ne cerem scuze pentru că nu am citat multe publicații importante din cauza limitărilor de spațiu.
9. Bernhard W. surfactant pulmonar: funcția și compoziția în contextul dezvoltării și fiziologiei respiratorii. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract | CrossRef Textul Complet | Google Scholar
10. Wright JR., „Înțelepciunea” surfactantului pulmonar: echilibrarea apărării gazdei și a funcțiilor de reducere a tensiunii superficiale. Am J Physiol Pulmonar Cell Mol Physiol. (2006) 291: L847–50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstract | CrossRef Textul Complet | Google Scholar
11. Schicht M, Garreis F, Tanzer N, Beileke S, Jacobi C, Sahin a, et al. SFTA3 – o proteină surfactantă nouă a suprafeței oculare și rolul său în vindecarea rănilor corneene și tensiunea superficială a filmului lacrimal. Sci Rep. (2018) 8: 9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. terapia cu Surfactant la sugarii prematuri cu sindrom de detresă respiratorie și la nou-născuții la termen sau la termen cu RDS acută. J Perinatol. (2006) 26 (supl. 1): S51–6; discuție S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstract | CrossRef Textul Complet | Google Scholar
16. Am fost JV, Zimmermann LJ. Ce este nou în surfactant? O viziune clinică asupra evoluțiilor recente în neonatologie și pediatrie. Europ J Pediatrics. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Textul Complet | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, și colab. Pumactant și poractant alfa pentru tratamentul sindromului de detresă respiratorie la nou-născuții la 25-29 săptămâni de gestație: un studiu randomizat. Lance. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar