Unic Chimie dintre cele mai Usoare Elemente
chimie a doua perioadă element din fiecare grup (n = 2: Li, Be, B, C, N, O și F) diferă în multe privințe de cea mai greu de membri, sau congeneri, de grup. În consecință, elementele celei de-a treia perioade (n = 3: Na, Mg, Al, Si, P, S și Cl) sunt, în general, mai reprezentative pentru grupul din care fac parte., Chimia anormală a elementelor din a doua perioadă rezultă din trei caracteristici importante: raze mici, orbite d indisponibile energetic și tendința de a forma legături pi (π) cu alți atomi.
spre deosebire de chimia elementelor din a doua perioadă, chimia elementelor din a treia perioadă este mai reprezentativă pentru chimia grupului respectiv.
datorită razelor lor mici, elementele din a doua perioadă au afinități de electroni care sunt mai puțin negative decât s-ar anticipa din tendințele periodice generale., Când un electron este adăugat la un atom atât de mic, repulsiile electron–electron crescute tind să destabilizeze anionul. Mai mult, dimensiunile mici ale acestor elemente îi împiedică să formeze compuși în care au mai mult de patru vecini apropiați. Astfel, BF3 formează doar ionul BF4 tetraedric cu patru coordonate, în timp ce în aceleași condiții AlF3 formează ionul AlF63 octaedric cu șase coordonate. Datorită dimensiunii atomice mai mici, compușii ionici binari simpli ai elementelor din a doua perioadă au, de asemenea, un caracter covalent mai mare decât compușii corespunzători formați din congenerii lor mai grei., Cationii foarte mici derivați din elementele din a doua perioadă au un raport mare de încărcare-rază și, prin urmare, pot polariza învelișul de valență umplut al unui anion. Ca atare, legarea în astfel de compuși are o componentă covalentă semnificativă, dând proprietăților compușilor care pot diferi semnificativ de cele așteptate pentru compușii ionici simpli. De exemplu, LiCl, care are un caracter parțial covalent, este mult mai solubil decât NaCl în solvenți cu o constantă dielectrică relativ scăzută, cum ar fi etanolul (ε = 25,3 față de 80,1 pentru H2O).,deoarece orbitalii d nu sunt niciodată ocupați pentru numere cuantice principale mai mici de 3, electronii de valență ai elementelor din a doua perioadă ocupă doar orbitalii 2s și 2p. Energia orbitalilor 3D depășește cu mult energia orbitalilor 2S și 2P, astfel încât utilizarea lor în legătură este prohibitivă din punct de vedere energetic. În consecință, pur și simplu nu se observă configurații de electroni cu mai mult de patru perechi de electroni în jurul unui element central, din a doua perioadă. Este posibil să vă amintiți că rolul orbitalilor d în legarea în compușii grupului principal cu numere de coordonare de 5 sau mai mari rămâne oarecum controversat., De fapt, descrierile teoretice ale legăturii în molecule precum SF6 au fost publicate fără a menționa participarea orbitalilor d asupra sulfului. Argumentele bazate pe disponibilitatea D-orbitală și pe dimensiunea redusă a atomului central prevăd totuși că numerele de coordonare mai mari de 4 sunt neobișnuite pentru elementele celei de-a doua perioade, ceea ce este în acord cu rezultatele experimentale.,una dintre cele mai dramatice diferențe dintre cele mai ușoare elemente ale grupului principal și congenerii lor mai grei este tendința elementelor din a doua perioadă de a forma specii care conțin legături multiple. De exemplu, N este chiar deasupra P în grupa 15: N2 conține o legătură N≡N, dar fiecare atom de fosfor din P4 tetraedric formează trei legături P–P. Această diferență de comportament reflectă faptul că în cadrul aceluiași grup al tabelului periodic, energiile relative ale legăturii π și ale legăturii sigma (σ) diferă. O legătură C=C, de exemplu, este cu aproximativ 80% mai puternică decât o legătură C–C., În schimb, o legătură Si=Si, cu o suprapunere mai mică p-orbitală între orbitalii de valență ai atomilor legați din cauza dimensiunii atomice mai mari, este cu aproximativ 40% mai puternică decât o legătură Si–si. În consecință, compușii care conțin legături multiple și unice de la C la C sunt obișnuiți pentru carbon, dar compușii care conțin numai legături sigma Si–Si sunt mai favorabili din punct de vedere energetic pentru siliciu și celelalte elemente din a treia perioadă.,
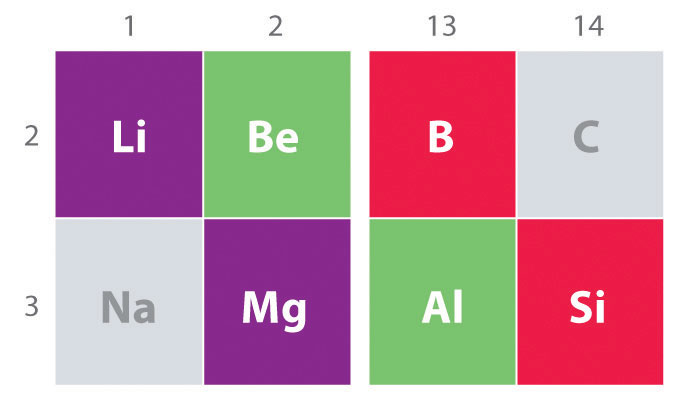
o Altă tendință importantă de a nota în grupa principală chimie este chimic similitudinea dintre cel mai ușor element de un grup și elementul imediat mai jos și la dreapta de ea în următorul grup, un fenomen cunoscut sub numele de diagonala efect (Figura \(\PageIndex{2}\)) Acolo sunt, de exemplu, semnificative similitudini între chimia Li și Mg, Fie și Al, și B și si. Atât Becl2 cât și AlCl3 au un caracter covalent substanțial, deci sunt oarecum solubili în solvenți organici nepolari., În schimb, deși Mg și Be sunt în același grup, MgCl2 se comportă ca o halogenură Ionică tipică datorită electronegativității mai mici și dimensiunii mai mari a magneziului.