wprowadzenie
wirus SARS-COV-2 rozprzestrzenił się już na cały świat i jest obecnie, bez dostępnej jeszcze szczepionki, nie do powstrzymania. Jak na dzień dzisiejszy, COVID-19 wpływa na więcej niż 3,000,000 potwierdzonych pacjentów na całym świecie. Leki pierwszego rzutu są leki przeciwwirusowe i wiele pilnych badań klinicznych są w toku., Jednakże niedawne badanie kliniczne, w którym oceniano połączenie inhibitora proteazy HIV lopinawiru i rytonawiru, nie wykazało istotnego działania przeciwwirusowego przeciwko SARS-CoV-2 u pacjentów z ciężką chorobą (1). Dopóki nie mamy specyficznych terapii przeciwwirusowych przeciwko SARS-CoV-2, musimy zapewnić leczenie objawowe podtrzymujące, aby zapobiec niewydolności płuc, najczęstszej przyczynie śmiertelności COVID-19.,
komórki pęcherzykowe typu II są uszkodzone przez zakażenie wirusowe SARS-COV-2
i wynikające z tego zniszczenie komórek pęcherzykowych przyciągają komórki odpornościowe z nadmierną wysiękową i śródmiąższową reakcją zapalną. Burza produkcji cytokin i chemokin powoduje zniszczenie tkanki płucnej i ostatecznie w ciężkim ostrym zespole niewydolności oddechowej (Ards). SARS-CoV – 2 oraz SARS-COV dostają się do komórek przez receptor enzymu konwertującego angiotensynę 2 (ACE2)., ACE2 wykazuje wysoką ekspresję na powierzchni wierzchołkowej nabłonka dróg oddechowych, śródbłonka naczyniowego, tkanki nerkowej i sercowo-naczyniowej, a także różnych innych komórek (2). W miarę przedostawania się przez drogi oddechowe SARS-CoV i SARS-COV-2 mogą w szczególny sposób niszczyć komórki, które głównie wyrażają receptor ACE2 na swoich powierzchniach, a mianowicie komórki pęcherzykowe typu II (2, 3).
jako komórki progenitorowe nabłonka pęcherzykowego, komórki pęcherzykowe typu II są „obrońcami pęcherzyka płucnego” (4)., Utrzymują homeostazę pęcherzyków płucnych, zwłaszcza po uszkodzeniu płuc przez drobnoustroje, gdzie kontrolują odpowiedź zapalną.
poprzez produkcję ochronnego środka powierzchniowo czynnego płuca, komórki pęcherzykowe typu II zmniejszają napięcie powierzchniowe płuc, ułatwiając w ten sposób oddychanie i wymianę gazową, a ponadto są kluczowe dla procesów naprawczych po urazie (5) (ryc. 1). Uszkodzenia komórek pęcherzykowych typu II drastycznie zmniejszają produkcję i wydzielanie surfaktantu płucnego do przestrzeni pęcherzykowej., Następnie następuje atelektaza spowodowana dysfunkcją surfaktantu płucnego, która dodatkowo zmniejsza zgodność płuc (6). Interfaza powietrze-ciecz jest zaburzona u pacjentów zakażonych SARS-CoV-2, co prowadzi do uszkodzenia płuc. ACE2 sam chroni przed uszkodzeniem płuc, chociaż mechanizmy przeciwzapalne i przeciw włókniste. Tak więc zastosowanie rekombinowanego enzymu konwertującego angiotensynę (ACE) nie tylko blokuje miejsca wiązania receptorów wirusa, ale także zapewnia ochronę płuc. W scenariuszu, w którym SARS-CoV-2 wiąże się z ACE2, ochronne Wiązanie ACE jest znacznie zmniejszone., Po zniszczeniu komórek pęcherzykowych następuje zmniejszone utlenowanie krwi, zwłóknienie płuc, obrzęk, upośledzenie regeneracji i ostatecznie prowadzi do niewydolności oddechowej (7).
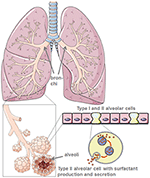
Rysunek 1. Model morfologii płuc i pęcherzyków płucnych. Surfaktant płuca jest wytwarzany przez komórki pęcherzykowe typu II. Stworzony przy użyciu smart servier medical art pod https://creativecommons.org/licenses/by/3.0/.,
środek powierzchniowo czynny w płucach jako ochronna terapia przeciwzapalna ARDS
niewydolność oddechowa jest również znana z zupełnie innego pochodzenia, a mianowicie u wcześniaków ze zmniejszoną produkcją środka powierzchniowo czynnego w płucach w porównaniu do urodzonych dzieci. Bez wystarczającej ilości surfaktantu płucnego, pęcherzyki płucne zapadają się podczas wydechu, co powoduje słabe natlenienie krwi.
powierzchnie płuc przedstawiają międzyfazę powietrze-ciecz i są w ciągłym ruchu podczas in-i wydechu. Ten ostatni stwarza ryzyko zapadnięcia się tkanki z powodu napięcia powierzchniowego płynu., Płuco przezwycięża to niebezpieczeństwo, pokrywając powierzchnię środkiem powierzchniowo czynnym płuca. Środek powierzchniowo czynny płuca jest wytwarzany w wyspecjalizowanych komórkach znajdujących się w końcowych gałęziach płuca, komórkach pęcherzykowych typu II, które zaczynają wytwarzać środek powierzchniowo czynny płuca natychmiast po urodzeniu (8).
środek powierzchniowo czynny płuca jest mieszaniną fosfolipidów i czterech białek powierzchniowo czynnych (SP), a mianowicie hydrofilowych SP-A I SP-D, zwanych również kolektynami, oraz lipofilowych SP-B I SP-C (9). Środek powierzchniowo czynny płuc obniża napięcie powierzchniowe i tym samym zapobiega zapadaniu się pęcherzyków płucnych podczas wydechu., Wszystkie SP przyczyniają się do wrodzonej odpowiedzi immunologicznej płuc, podczas gdy SP-B I SP-C wpływają również na konsystencję bogatego w fosfolipidy środka powierzchniowo czynnego (10). Niedawno opisano nowe białka związane z surfaktantem (SFTA) o podobnych właściwościach w porównaniu z „klasycznym” SP (11-13). SFTA2 jest hydrofilowy i wykazuje podobne właściwości w porównaniu z SP – A I SP-D (13). SFTA3 zwiększa fagocytozę linii komórkowych makrofagów (14) i jest białkiem amfifilowym (12)., Dlatego prawdopodobnie występuje w dostępnych na rynku lipofilowych ekstrakcjach płuc zwierząt i może zwiększać aktywność fagocytotyczną makrofagów przeciwko CoV-2.
u wcześniaków produkcja surfaktantu w płucach jest niewystarczająca, przy słabym natlenieniu krwi i wysokim napięciu powierzchniowym pęcherzyków, co prowadzi do nasilenia reakcji zapalnych.
począwszy od końca lat siedemdziesiątych, egzogenny środek powierzchniowo czynny płuca bydła lub świń pochodzący z płukania oskrzeli został z powodzeniem ustanowiony jako terapia ARDS u wcześniaków., Leczenie preparatami powierzchniowo czynnymi płuc prowadzi do zwiększenia natlenienia i zwiększenia przeżywalności (15-17). Należy zauważyć, że leczenie naturalnie występującym środkiem powierzchniowo czynnym w płucach przyniosło lepsze wyniki pod względem przeżywalności niemowląt w porównaniu z syntetycznym środkiem powierzchniowo czynnym w płucach (17). Naturalne środki powierzchniowo czynne płuc to mieszanina lipidów (90%) i białek powierzchniowo czynnych (10%), które regulują aktywność makrofagów pęcherzykowych i zmniejszają stan zapalny. Lipofilowa frakcja powierzchniowo czynnego środka płucnego ma właściwości przeciwzapalne, gdy jest stosowana donosowo do płuc (18) oraz miejscowo na skórę (19)., W skórze środek powierzchniowo czynny płuca zmniejsza ekspresję genów prozapalnych i pro fibrotic w ranach in vivo. W różnych modelach zapalenia ran in vitro i In vivo mysie i ludzkie, środek powierzchniowo czynny płuca zmniejszał TNF-α, TACE I IL-6 (19), które są znacznie podwyższone u pacjentów z ciężkim zakażeniem COVID-19.
ostatnie odkrycia pokazują, że SARS-CoV-2 indukuje niszczenie komórek pęcherzykowych typu II w towarzyszącym covid-19 zapaleniu płuc (2). Dokładnie te komórki wytwarzają surfaktant płucny i zapobiegają zapadaniu się płuc., Ponadto limfocytopenia z masowym uwalnianiem cytokin jest kolejnym czynnikiem prowadzącym do niewydolności płuc i śmierci w ciężkich przypadkach pacjentów z COVID-19. Dlatego sugerowano, że cele przeciwzapalne, takie jak anty-TNF i anty-IL-6, lepiej kontrolują ciężkie zakażenie COVID-19 (20).,
dyskusja: zastosowanie środka powierzchniowo czynnego w płucach do odbudowy bariery płucnej u pacjentów z zapaleniem płuc COVID-19
chociaż leczenie środkiem powierzchniowo czynnym w płucach jest standardową, bardzo bezpieczną i skuteczną terapią u noworodków z ARDS, leczenie rekombinowanym środkiem powierzchniowo czynnym opartym na SP-C nie wykazało poprawy przeżycia w dużych randomizowanych kontrolowanych badaniach klinicznych u dorosłych (18). Co ważne, stosowanie naturalnych środków powierzchniowo czynnych wydaje się być korzystne w porównaniu z syntetycznymi środkami powierzchniowo czynnymi (16, 17) ze znaczną poprawą natlenienia krwi i krótszym czasem wentylacji u niemowląt (16)., Zespół aspiracji smółki przypomina zapalenie płuc COVID-19 ze zmniejszoną produkcją surfaktantu i zniszczeniem komórek pęcherzykowych typu II (21). Wczesne podawanie naturalnego środka powierzchniowo czynnego w płucach skróciło terapię ECMO i czas wentylacji (21). Sugeruje to, że wczesne podawanie naturalnego środka powierzchniowo czynnego w płucach może rzeczywiście poprawić czynność płuc również u dorosłych pacjentów z ciężkimi ARDS, podczas gdy przyczyną śmierci nie może być samo zapadnięte płuco, ale raczej niewydolność wielonarządowa., Poza tym różne czynniki ryzyka rozwoju ARDS i różne fenotypy implikują możliwe różne efekty ze względu na środki terapeutyczne. Tak więc, korzystne efekty terapii surfaktantem u pacjentów z ARDS związanych z COVID-19 są możliwe, zwłaszcza gdy stosowane na początku strategii leczenia przeciwko niewydolności płuc.,
ze względu na solidną skuteczność przeciwzapalną i ochronną płuc oraz dzisiejszą pilną potrzebę terapii wspomagającej płuca, proponujemy leczenie uzupełniające pacjentów z zapaleniem płuc covid-19 na ICU z naturalnymi surfaktantami płucnymi, oprócz obecnego standardu leczenia intensywnej terapii Ards. Obecne dowody sugerują, że mogłoby to zwiększyć natlenienie krwi, zmniejszyć obrzęk płuc i złagodzić nadmierną reakcję zapalną stwierdzoną w autopsji płuc u pacjentów z COVID-19 (22)., Windtree therapeutics ™ ogłosił swój plan testowania KL4, syntetycznego środka powierzchniowo czynnego, u pacjentów z ciężkim zakażeniem COVID-19 (https://www.windtreetx.com/). W Niemczech Lyomark Pharma GmbH planuje przetestować swój naturalny wieloskładnikowy bovaktant powierzchniowo czynny w płucach również u dorosłych pacjentów z covid-19 z zapaleniem płuc (www.lyomark.com).
dostępny komercyjnie środek powierzchniowo czynny płuc jest stosunkowo tani jak na standardy OIOM, łatwo dostępny i nie ma znanych skutków ubocznych u dzieci i dorosłych., Należy zachować ostrożność u pacjentów ze stwierdzoną alergią na produkty pochodzenia bydlęcego lub wieprzowego, ponieważ surfaktanty płucne są pozyskiwane głównie z płuc bydła (bovaktant, Alveofact®) lub świń (poraktant alfa, Curosurf®) poprzez płukanie lub mielenie tkanek, a następnie ekstrakcję frakcji lipidowej.podanie
jest proste, dodając rozpuszczony liofilizat do rurki tchawiczej wentylowanego pacjenta, dostarczając lek bezpośrednio do przestrzeni pęcherzyków płucnych. Jeśli chodzi o bovaktant, nebulizator został niedawno zatwierdzony do użytku klinicznego w USA przez FDA., Pokrywając zewnętrzną powierzchnię pęcherzyków płucnych, środek powierzchniowo czynny działa bezpośrednio na komórki zapalne, zmniejszając produkcję cytokin i niszczenie tkanek. W ten sposób przywraca barierę płucną, a tym samym zapobiega zapadaniu się płuc (ryc. 2). W konsekwencji skróci to czas trwania terapii wentylacyjnej, ułatwi oddychanie, a tym samym przyczyni się do powrotu pacjentów do zdrowia.
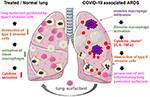
Rysunek 2. Hipotetyczny mechanizm zewnętrznie stosowanego środka powierzchniowo czynnego płuca do ochrony płuc w ciężkich ARDS związanych z COVID – 19., Związane z COVID-19 Ards charakteryzuje się masywnym naciekiem makrofagów, aktywacją makrofagów tkankowych i nasileniem produkcji cytokin w płucach (cytokina” burza”), co prowadzi do zniszczenia środka powierzchniowo czynnego produkującego komórki pęcherzykowe typu II, co pogarsza sytuację poprzez utratę przeciwzapalnego, przeciw włóknistego środka powierzchniowo czynnego płuca. Egzogenny środek powierzchniowo czynny może zmniejszyć stan zapalny, a tym samym przywrócić przeżycie płucne. Stworzony przy użyciu smart servier medical art pod https://creativecommons.org/licenses/by/3.0/.,
wkład autora
wszyscy autorzy przyczynili się do zaprojektowania, napisania i konceptualizacji manuskryptu. UM i KM edytowali i projektowali figury.
konflikt interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
chcielibyśmy podziękować Desiree Schumann (Uniwersytet w Bazylei) za jej wnikliwe wsparcie w pisaniu tego rękopisu., Autorzy są wspierani przez niemiecką Fundację badawczą (DFG) i JDRF. Przepraszamy za brak cytowania wielu ważnych publikacji ze względu na ograniczenia przestrzenne.
9. Bernhard W. Lung surfactant: function and composition in the context of development and respiratory physiology. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Wright JR., „Mądrość” surfaktantu płucnego: równoważenie funkcji obrony gospodarza i zmniejszania napięcia powierzchniowego. Am J Physiol Lung Cell Mol Physiol. (2006) 291:L847-50. podoba mi się! do obserwowanych nr: 10115200261.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-nowe białko powierzchniowo czynne powierzchni oka i jego rola w gojeniu się ran rogówki i napięciu powierzchniowym filmu łzowego. Sci Rep. (2018) 8: 9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. leczenie surfaktantem u wcześniaków z zespołem niewydolności oddechowej oraz u noworodków niedojrzałych lub terminowych z ostrym RDS. J Perinatol. (2006) 26(Suppl. 1): S51–6; dyskusja S63-4. doi: 10.1038/SJ.jp.7211474
PubMed Abstract | CrossRef Full Text/Google Scholar
16. Been JV, Zimmermann LJ. Co nowego w surfaktancie? A clinical view on recent developments in neonatology and pediatrics. Europ J Pediatria. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumaktant i poraktant alfa w leczeniu zespołu niewydolności oddechowej u noworodków urodzonych w 25-29 tygodniu ciąży: randomizowane badanie. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar