unikalna Chemia najlżejszych pierwiastków
Chemia pierwiastka drugiego okresu każdej grupy (N = 2: Li, Be, B, C, N, O I F) różni się pod wieloma ważnymi względami od chemii cięższych członków lub kongenerów grupy. W konsekwencji elementy trzeciego okresu (N = 3: Na, Mg, Al, Si, P, S i Cl) są na ogół bardziej reprezentatywne dla grupy, do której należą., Anomalna Chemia pierwiastków drugiego okresu wynika z trzech ważnych cech: małych promieni, energetycznie niedostępnych orbitali d i tendencji do tworzenia wiązań pi (π) z innymi atomami.
w przeciwieństwie do chemii pierwiastków drugiego okresu, Chemia pierwiastków trzeciego okresu jest bardziej reprezentatywna dla chemii danej grupy.
ze względu na swoje małe promienie, pierwiastki drugiego okresu mają powinowactwa elektronowe, które są mniej ujemne niż można by przewidzieć z ogólnych trendów okresowych., Gdy elektron jest dodawany do tak małego atomu, zwiększone odpychanie elektronów ma tendencję do destabilizacji anionu. Ponadto niewielkie rozmiary tych pierwiastków uniemożliwiają im tworzenie związków, w których mają więcej niż czterech najbliższych sąsiadów. W ten sposób BF3 tworzy tylko czterodrzwiowy, czterodrzwiowy jon BF4, podczas gdy w tych samych warunkach AlF3 tworzy sześcio współrzędny, ośmiodrzwiowy Jon AlF63. Ze względu na mniejszy rozmiar atomowy, proste binarne związki jonowe pierwiastków drugiego okresu mają również bardziej kowalencyjny charakter niż odpowiadające im związki utworzone z ich cięższych kongenerów., Bardzo małe kationy pochodzące z pierwiastków drugiego okresu mają wysoki stosunek ładunku do promienia i dlatego mogą polaryzować wypełnioną powłokę walencyjną anionu. Jako takie wiązanie w takich związkach ma znaczący składnik kowalencyjny, co daje właściwości związków, które mogą znacznie różnić się od tych oczekiwanych dla prostych związków jonowych. Na przykład LiCl, który ma częściowo kowalencyjny charakter, jest znacznie bardziej rozpuszczalny niż NaCl w rozpuszczalnikach o stosunkowo niskiej stałej dielektrycznej, takich jak etanol (ε = 25,3 w porównaniu do 80,1 dla H2O).,
ponieważ orbitale d nigdy nie są zajęte dla głównych liczb kwantowych mniejszych niż 3, elektrony walencyjne pierwiastków drugiego okresu zajmują tylko orbitale 2S i 2p. Energia orbitali 3d znacznie przekracza energię orbitali 2S i 2P, więc używanie ich w wiązaniu jest energicznie zaporowe. W związku z tym konfiguracje elektronów z więcej niż czterema parami elektronowymi wokół centralnego pierwiastka drugiego okresu po prostu nie są obserwowane. Można przypomnieć, że rola orbitali d w wiązaniu w głównych związkach grupowych o liczbie Koordynacyjnej 5 lub wyższej pozostaje nieco kontrowersyjna., W rzeczywistości teoretyczne opisy wiązania w cząsteczkach takich jak SF6 zostały opublikowane bez wspominania o udziale orbitali d na siarce. Argumenty oparte na dostępności orbitali d i na małych rozmiarach atomu centralnego przewidują jednak, że liczby koordynacyjne większe niż 4 są nietypowe dla pierwiastków drugiego okresu, co jest zgodne z wynikami eksperymentalnymi.,
jedną z najbardziej dramatycznych różnic między najlżejszymi głównymi pierwiastkami grupy a ich cięższymi kongenerami jest tendencja pierwiastków drugiego okresu do tworzenia gatunków zawierających wiązania wielokrotne. Na przykład N jest tuż powyżej P w grupie 15: N2 zawiera Wiązanie N≡N, ale każdy atom fosforu w czworościennym P4 tworzy trzy wiązania P-P. Ta różnica w zachowaniu odzwierciedla fakt, że w tej samej grupie układu okresowego, względne Energie wiązania π i wiązania sigma (σ) różnią się. Na przykład Wiązanie C=C jest o około 80% silniejsze niż Wiązanie C-C., W przeciwieństwie do tego, Wiązanie Si=Si, z mniejszym nakładaniem się orbitali P pomiędzy orbitalami walencyjnymi wiązanych atomów ze względu na większy rozmiar atomów, jest tylko o około 40% silniejsze niż Wiązanie Si–Si. W związku z tym związki zawierające zarówno wielokrotne, jak i pojedyncze wiązania C do C są wspólne dla węgla, ale związki zawierające tylko wiązania sigma Si-Si są bardziej energicznie korzystne dla krzemu i innych pierwiastków trzeciego okresu.,
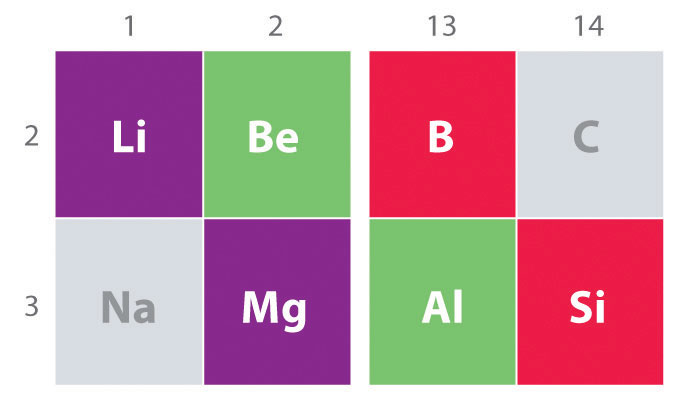
innym ważnym trendem, który należy zauważyć w chemii grupy głównej, jest podobieństwo chemiczne między najlżejszym pierwiastkiem jednej grupy a pierwiastkiem bezpośrednio poniżej i na prawo od niego w następnej grupie, zjawisko znane jako efekt przekątnej (rysunek \(\PageIndex{2}\)) istnieją na przykład znaczące podobieństwa między chemią Li I Mg, Be I Al oraz B I Si. Zarówno BeCl2, jak i AlCl3 mają znaczny charakter kowalencyjny, więc są nieco rozpuszczalne w niepolarnych rozpuszczalnikach organicznych., W przeciwieństwie do tego, chociaż Mg I Be są w tej samej grupie, MgCl2 zachowuje się jak typowy halogenek jonowy ze względu na niższą elektroujemność i większy rozmiar magnezu.