Laget av MakeTheBrainHappy.
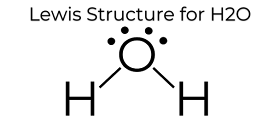
H2O ‘ s Lewis Dot Struktur gir det mange unike egenskaper hovedsakelig skyldes to ensomme par på sentrale oksygen atom. Dette øker elektron-elektron frastøting og derfor skaper en bøyd struktur, i motsetning til CO2 er lineær struktur. Denne «bøyd» molekylære strukturen gir det mange unike egenskaper som å være polar., En av de mest fascinerende fenomener er ideen om «hydrogenbinding» som påvirker vannets egenskaper dramatisk.
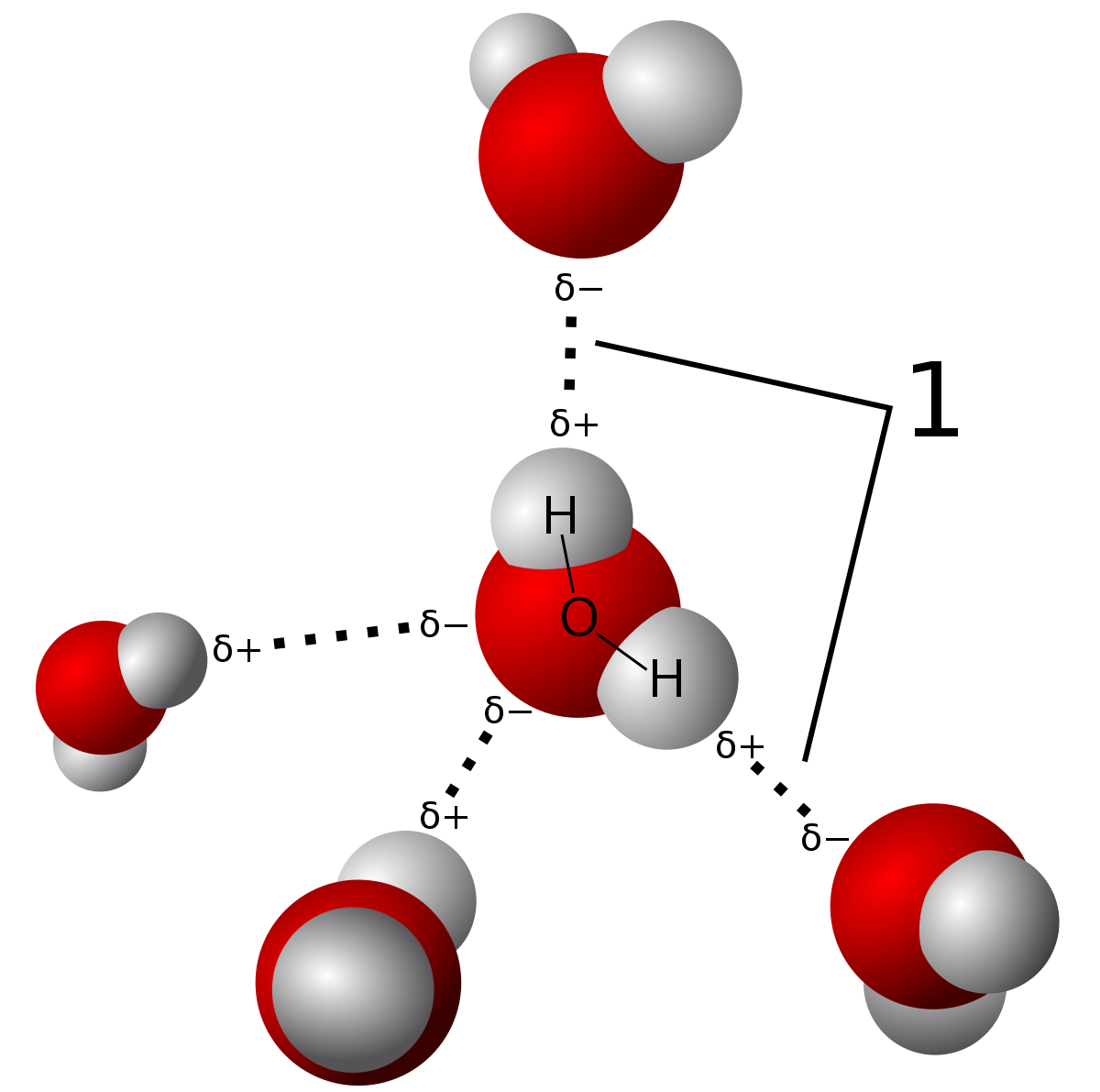
hydrogenbinding er en type intermolecular force hvor electronegativity forskjell i oksygen atom fører til en delvis permanent dipol å danne seg mellom hydrogen og oksygen atomer (vist med den stiplede linjer). Obligasjoner i vann molekylet selv er covalent obligasjoner. Du kan lese mer om forskjellen i dette innlegget., Kilde
på Grunn av styrken av disse hydrogen obligasjoner, vann, har et relativt høyt smeltepunkt og kokepunkt, selv om de ikke er så høy som nettverk covalent faste stoffer. De er bundet av intramolecular styrker som involverer de faktiske deling av elektroner vs. delvis dipol-styrker i hydrogen obligasjoner. Det er bare tre typer obligasjoner som kan hydrogen bond. Disse er N-H-O-H-og F-H bindinger på grunn av den store electronegativity forskjeller mellom molekyler.,
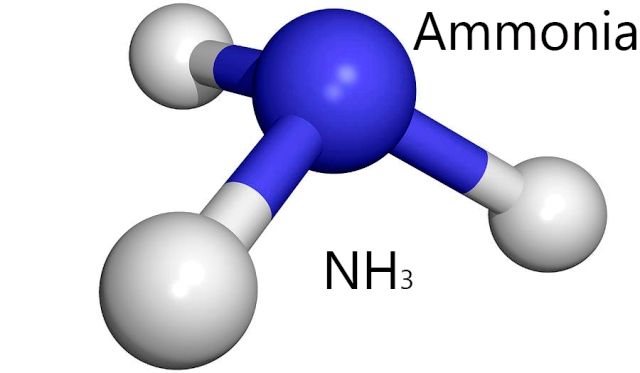
NH3 er et annet molekyl som skaper lignende hydrogen obligasjoner som H2O. Kilde
Hva andre egenskaper gjør vannet?
Vann er en av de eneste elementene som finnes i alle tre land (fast, flytende og gassform) naturlig på jorden. Hydrogen binding fører til en krystallinsk struktur som gjør det mindre tett enn flytende vann. Dette er grunnen til at is flyter i havet. Vann har også en høy overflatespenning og heft., Samhold og heft er helt nødvendig for at planter som manipulerer disse prosessene for å flytte vann fra røttene til blad for å støtte veksten av planten. Alt dette er forårsaket av den enkle strukturen av H2O, representert ved Lewis Dot Diagrammet over.

Vann molekyler i alle tre statene i saken. Kilde