Unike Kjemi av de Letteste Elementene
kjemien i andre periode element i hver gruppe (n = 2: Li, Be, B, C, N, O og F) skiller seg på mange viktige måter fra tyngre medlemmer, eller congeners, av gruppen. Derfor elementer av den tredje perioden (n = 3: Na, Mg, Al, Si, P, S og Cl) er generelt mer representativt for den gruppen de tilhører., Den avvikende kjemi av andre-elementer fra perioden resultater fra tre viktige kjennetegn: små radier, energisk utilgjengelig d orbitals, og en tendens til å danne pi (π) bindinger med andre atomer.
I motsetning til kjemien i andre periode elementer, kjemien i tredje periode elementer er mer representativt for kjemi av den respektive gruppen.
på Grunn av sine små radier, andre-elementer fra perioden har electron slektskap som er mindre negativ enn det som ville bli spådd fra generelle periodiske trender., Når et elektron er lagt til en så liten atom, økt elektron–elektron repulsions har en tendens til å destabilisere den anion. Videre, de små størrelser av disse elementene hindre dem fra å danne forbindelser som de har mer enn fire nærmeste naboer. Dermed BF3 former bare fire-koordinat, tetrahedral BF4− ion, mens under de samme betingelsene som AlF3 danner seks-koordinat, oktaedrisk AlF63− ion. På grunn av mindre atomic størrelse, enkle binære ioniske forbindelser med andre elementer fra perioden også har mer covalent karakter enn de tilsvarende forbindelser dannet fra deres tyngre congeners., Det som er veldig lite kationer som er avledet fra andre-elementer fra perioden har en høy kostnad-til-radius-forhold, og kan derfor polarize fylt valence skallet av en anion. Som sådan, bonding i slike forbindelser har en betydelig covalent komponent, noe som gir forbindelser egenskaper som kan avvike fra de som er forventet for enkel ioniske forbindelser. Som et eksempel, LiCl, som er delvis covalent i karakter, mye mer løselig enn NaCl i løsemidler med en relativt lav dielektrisk konstant, for eksempel etanol (ε = 25.3 versus 80 år.1 for H2O).,
Fordi d orbitals er aldri okkupert for rektor quantum tall mindre enn 3, valence elektroner til andre-elementer fra perioden okkupere 2s og 2p orbitals bare. Energien i 3d-orbitals er langt høyere enn energien til 2s og 2p orbitals, så å bruke dem i bånd er energisk uoverkommelige. Følgelig, elektron-konfigurasjoner med mer enn fire electron par rundt en sentral, andre-perioden element er rett og slett ikke observert. Du husker kanskje at rollen d orbitals i bånd i største gruppe forbindelser med koordinering tall på 5 eller høyere er fortsatt noe uavklart., Faktisk, teoretiske beskrivelser av bindinger i molekyler som SF6 har blitt publisert, uten å nevne deltakelse av d orbitals på svovel. Argumenter basert på d-orbital tilgjengelighet og på den lille størrelsen av den sentrale atom, men spår at koordinering tall som er større enn 4 er uvanlig for elementene i den andre perioden, noe som er i overensstemmelse med eksperimentelle resultater.,
En av de mest dramatiske forskjeller mellom de lyseste største gruppen elementer og deres tyngre congeners er tendensen i den andre perioden elementer for å danne arter som inneholder flere obligasjoner. For eksempel er N like over P i gruppe 15: N2 inneholder en N≡N bond, men hver fosfor atom i tetrahedral P4 former tre P–P obligasjoner. Denne forskjellen i atferd gjenspeiler det faktum at i den samme gruppen av den periodiske tabellen, er den relative energier av π bond og sigma (σ) obligasjonslån forskjellige. A C=C bond, for eksempel, er ca 80% sterkere enn en C–C bond., I kontrast, kan en Si=Si bond, med mindre p-orbital overlapp mellom valence orbitals av atomer bundet på grunn av større atomic størrelse, er bare om lag 40% sterkere enn en Si–Si-bond. Følgelig, forbindelser som inneholder både flere, og enkelt P å C obligasjoner er felles for karbon, men forbindelser som inneholder bare sigma-Si–Si-obligasjoner er mer energetisk gunstig for silisium og andre tredje periode elementer.,
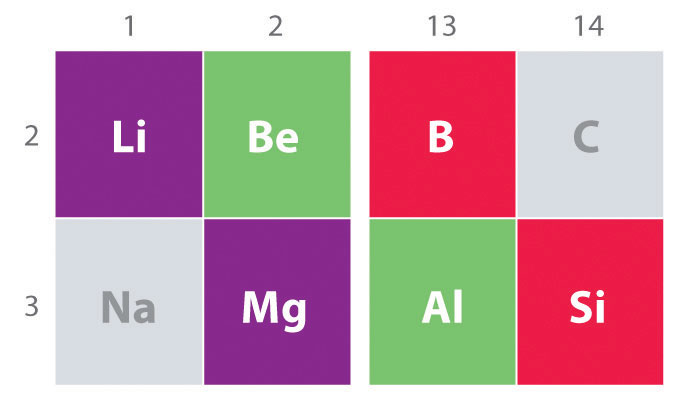
en Annen viktig trend å merke seg i største gruppe kjemi er den kjemiske likheten mellom de lyseste del av en gruppe og element umiddelbart nedenfor og til høyre på det i neste gruppe, et fenomen som er kjent som den diagonal effekt (Figur \(\PageIndex{2}\)) Det er for eksempel betydelige likheter mellom kjemi av Li og Mg, og Al, og B og Si. Både BeCl2 og AlCl3 har betydelig covalent karakter, så de er litt løselig i upolare organiske løsningsmidler., I kontrast, selv om Mg og Være i samme gruppe, MgCl2 oppfører seg som en typisk ioniske halide på grunn av lavere electronegativity og større størrelsen av magnesium.