독특한 화학의 가벼운 요소
화학의 기간 요소의 각 그룹(n=2:리야,B,C,N,O,F)에서 차이가 많은 중요한 측면에서는 더 무거운 구성원,또는 동종의 그룹입니다. 결과적으로 세 번째 기간(n=3:Na,Mg,Al,Si,P,S 및 Cl)의 요소는 일반적으로 그들이 속한 그룹보다 대표적입니다., 변화학의 기간 요소에서 결과는 세 가지 중요한 특징:작은 반경,정력적으로 사용할 수 없 d orbitals,그리고 추세를 형성하 pi(π)채권과 다른 원자를 함유하고 있습니다.
에서 대비하고 화학의 기간 요소,화학의 세 번째 요소 기간이 더 많은 대표자의 화학의 각각의 그룹입니다.
으로 인해 자신의 작은 반경,중고 기간 요소가 전자 선호도는 더 적은 부정적인 것보다는 예측에서는 일반 정기적인 트렌드., 전자가 그러한 작은 원자에 첨가 될 때,증가 된 전자–전자 반발은 음이온을 불안정하게 만드는 경향이있다. 또한,작은 크기의 이러한 요소들에서 그들을 막을 형성하는 화합물에 있는 더 이상의 가장 가까운 이웃이 있습니다. 따라서 BF3 형태만 네 개의 좌표계,사면체 배틀필드 4−이온 반면,동일한 조건 하에서 AlF3 형태의 협조,팔면체 AlF63−이온입니다. 때문에 작은 원자 크기는 간단한 바이너리 이오니아 화합물의 두 번째 요소들 또한 더 많은 공유결 문자보다는 해당 화합물을 형성에서 그들의 무거운 congeners., 아주 작은 양이온에서 파생 된 두 번째 요소들이 높은 요금을 반경의 비율 및 수 있습니다 따라서 극 가득한 원자의 껍질의 음이온. 그러므로,접착에서 이러한 화합물은 상당한 공유결성을 제공,화합물의 속성에는 크게 다를 수 있습니다 그들에서 예상한 간단한 이오니아합니다. 예를 들어,licl 위상은 부분적으로 공유 문자에,더 많은 수용성보다 NaCl 용제에 상대적으로 낮은 상수 유전체,같은 에탄올(ε=25.3 대 80.1 에 대한 H2O).,
d 오비탈은 3 보다 작은 주요한 양자 수에 대해 결코 점유되지 않기 때문에,2 주기 원소의 원자가 전자는 2s 와 2p 오비탈만을 차지한다. 3d 인공 위성의 에너지는 2s 및 2p 인공 위성의 에너지를 훨씬 초과하므로 결합에 사용하는 것은 에너지 적으로 금지됩니다. 따라서,전자 구성으로 개 이상의 전자쌍을 중심,두 번째 요소 기간은 단순히 관찰되지 않습니다. 조정 번호가 5 이상인 주 그룹 화합물에서 결합에서 d 오비탈의 역할은 다소 논란의 여지가 있음을 상기 할 수 있습니다., 사실,sf6 와 같은 분자에서의 결합에 대한 이론적 설명은 황에 대한 d orbitals 의 참여를 언급하지 않고 발표되었다. 인수를 기반으로 d-궤도용성 및에서 작은 크기의 중심 원자로,그러나,예측 조정 숫자보다 큰 4 를 위해 특별한 요소의 두 번째 기간,계약 실험 결과입니다.,
중 가장 극적인 차이점이 가벼운 주요 그룹의 요소와 그들의 무거운 동종의 경향이 두 번째 기간을 형성하는 요소를 종을 포함하는 여러 수 있습니다. 예를 들어,n 은 그룹 15 에서 p 바로 위에 있습니다:N2 는 N≡N 결합을 포함하지만,사면체 P4 의 각 인 원자는 3 개의 P–P 결합을 형성합니다. 이 행동의 차이는 주기율표의 동일한 그룹 내에서 γ 결합과 시그마(σ)결합의 상대 에너지가 다르다는 사실을 반영합니다. 예를 들어 C=c 결합은 C–C 결합보다 약 80%강합니다., 대조적으로,Si=Si 채권 미만으로,p-궤도 사이에 겹치는 부분이 원자 궤도의 결합 원자 때문에 큰 원자 크기는 약 40%보다 강하 Si–Si 습니다. 따라서,화합물이 모두 포함하는 여러 개 및 싱글 C C 는 채권에 대한 일반적인 탄소이지만,포함하는 화합물만 sigma Si–Si 채권은 더 정력적으로 유리한 실리콘과 다른 기간 요소입니다.,
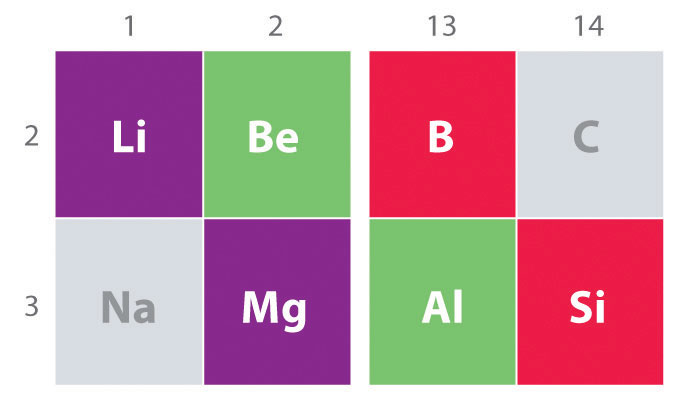
또 다른 중요한 동향을 참고 주요 그룹의 화학 화학적 유사성이 가벼운 요소의 하나는 그룹과 요소는 바로 아래와 오른쪽에서 그것의 다음 그룹으로 알려진 현상 대각선 효과(그림\(\PageIndex{2}\))이있다,예를 들어,중요한 유사성이 화학의 리튬 및 Mg,수와 알고,B and Si. BeCl2 와 AlCl3 는 모두 실질적인 공유 결합 특성을 가지므로 비극성 유기 용매에 다소 용해됩니다., 반면,하지만 Mg 고가 같은 그룹에 는 mgcl2 처럼 행동하는 일반적인 이온 할로겐로 인해 낮은 전기 음성과 더 큰 크기의 마그네슘.