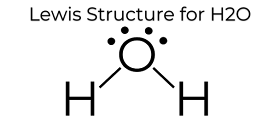
에 의해 만들어 MakeTheBrainHappy.
H2O 의 루이스 도 구조를 제공 그것은 많은 독특한 특성 때문에 주로 두 개의 고독한 쌍에 중 산소 원자입니다. 이것은 전자-전자 반발력을 증가시키고 따라서 CO2 의 선형 구조와 반대로 구부러진 구조를 만듭니다. 이”구부러진”분자 구조는 극성 인 것과 같은 많은 고유 한 특성을 제공합니다., 가장 매혹적인 현상 중 하나는 물 특성에 극적으로 영향을 미치는”수소 결합”이라는 아이디어입니다.
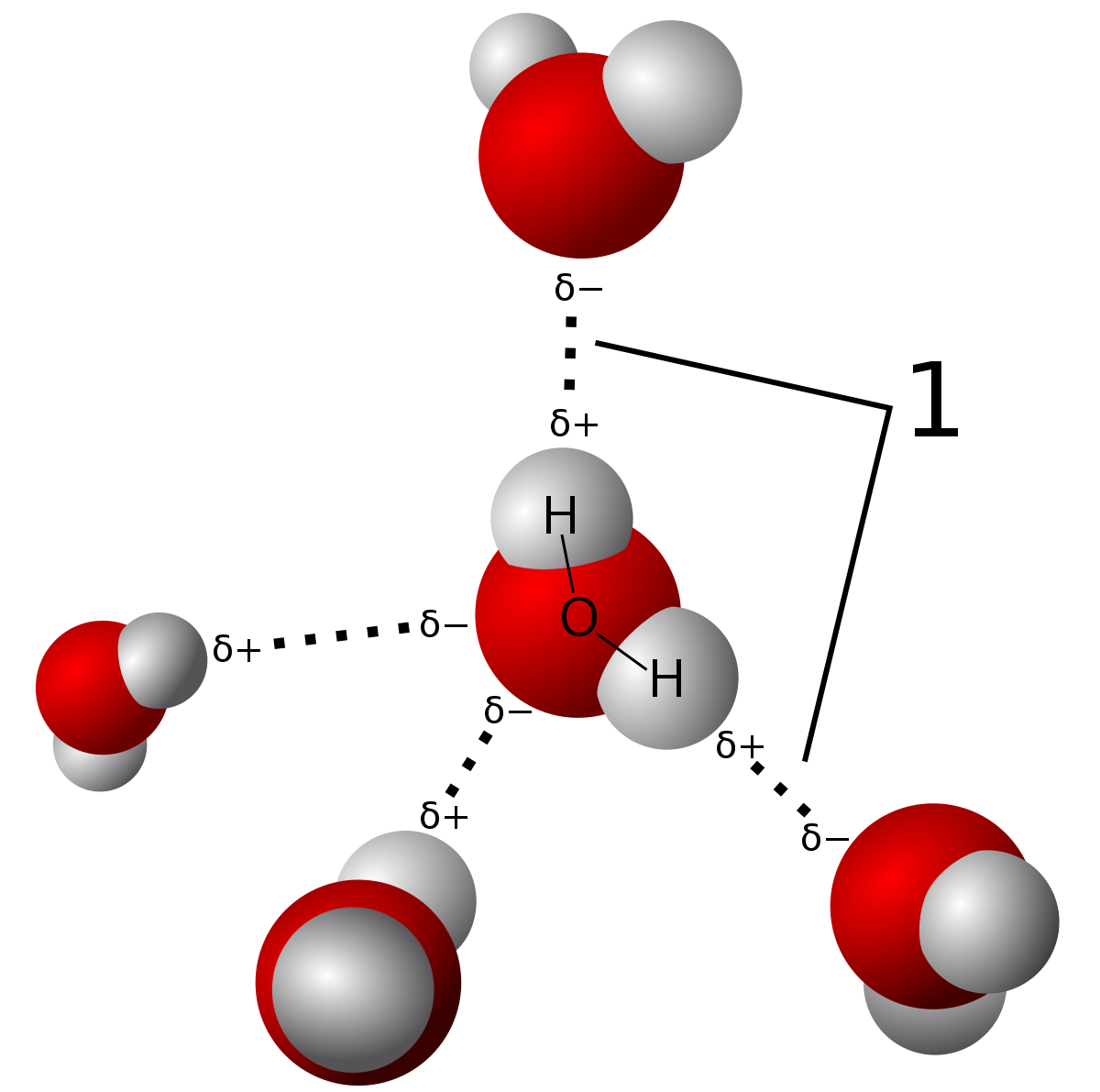
수소결합이 유형의 분자간의 힘는 전기 음성 차이에서 산소 원자 원인을 부분적 영원한 쌍극자 간의 양식을 수소 및 산소 원자(표시에 점선). 물 분자 자체의 결합은 공유 결합입니다. 이 게시물의 차이점에 대해 알아볼 수 있습니다., 원
때문에 강도의 이러한 수소 결합,물가는 상대적으로 높은 융과 끓는점이 있지만,그들은 높으로 네트워크 공유체. 그것들은 수소 결합에서 전자의 실제 공유 대 부분 쌍극자 힘을 포함하는 분자 내 힘에 의해 결합된다. 수소 결합 할 수있는 결합에는 세 가지 유형 만 있습니다. 이들은 분자 사이의 큰 전자 음성 차이로 인해 N-H,O-H 및 F-H 결합입니다.,
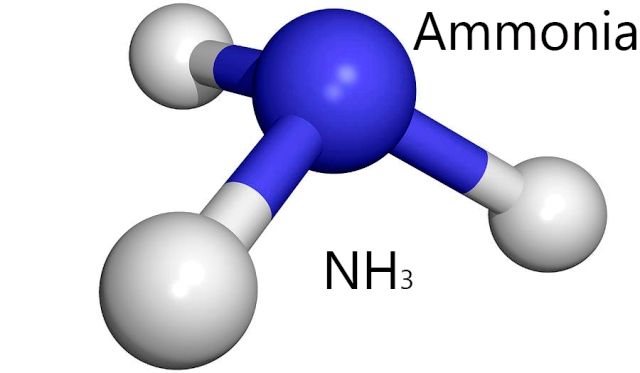
NH3 은 다른 분자를 만드는 비슷한 수소 결합으로 H2O. 원
어떤 다른 특성은 물이 있는가?
물 지구상에서 자연적으로 세 가지 상태(고체,액체 및 기체)에서 발견 될 수있는 유일한 요소 중 하나입니다. 수소 결합은 결정 구조를 유발하여 액체 물보다 밀도가 낮아집니다. 이것이 얼음이 바다에 떠있는 이유입니다. 물에는 또한 높은 표면 장력 및 접착력이 있습니다., 응집 및 접착은 필수적인 식물에는 조작하는 이러한 프로세스를 이동하는 물에서 뿌리잎을 지원하는 식물의 성장. 이 모든 것은 위의 Lewis Dot 다이어그램으로 표현 된 h2o 의 간단한 구조로 인해 발생합니다.

물질의 세 가지 상태 모두에서 물 분자. 소스