はじめに
コロナウイルスSARS-CoV-2はすでに全世界に広がっており、現在はまだワクチンが入手できていない。 今日のように、COVID-19は世界中で3,000,000人以上の確認された患者に影響を与えます。 最初の行の薬は抗ウイルス薬であり、複数の緊急臨床試験が進行中です。, しかし、HIVプロテアーゼ阻害剤の組み合わせロピナビルとリトナビルをテストする最近の臨床試験は、重度の疾患(患者におけるSARS-CoV-2に対する有意な抗ウイルス活性を示さなかった1)。 SARS-CoV-2に対する特異的な抗ウイルス療法がない限り、COVID-19死亡率の最も一般的な原因である肺不全を予防するために、支持的な対症療法を提供する必要があります。,
II型肺胞細胞はSARS-COV-2
ウイルス感染によって損傷を受け、結果として生じる肺胞細胞破壊は、過剰な肺胞ex出性および間質性炎症反応 サイトカインおよびケモカイン産生の嵐は、肺組織破壊をもたらし、最終的には重度の急性呼吸窮迫症候群(ARDS)をもたらす。 SARS-CoV-2およびSARS-CoVは、アンジオテンシン変換酵素受容体2(ACE2)を介して細胞に入る。, ACE2は、気道上皮、血管内皮、腎臓、および心臓血管組織ならびに他の様々な細胞の頂端表面に高度に発現している(2)。 それらが気道を通って入るとき、SARS-CoV、およびSARS-CoV-2は、それらの表面にACE2受容体を主に発現する細胞、すなわちII型肺胞細胞を特異的に破壊する可
肺胞上皮の前駆細胞として、II型肺胞細胞は”肺胞の擁護者”である(4)。, それらは、特に微生物肺損傷後、肺胞恒常性を維持し、そこで炎症反応を制御する。
保護性肺界面活性剤の産生により、II型肺胞細胞は肺の表面張力を低下させ、呼吸やガス交換を促進し、さらに外傷後の修復プロセスの中心となる(5)(図1)。 II型肺胞細胞への損傷は、肺胞腔への肺サーファクタントの産生および分泌を劇的に減少させる。, これに続いて、肺サーファクタント機能不全による無気肺が続き、肺コンプライアンスをさらに低下させる(6)。 Sars-CoV-2に感染した患者では、空気-液体-間期が摂動して肺損傷を引き起こす。 ACE2自体は、抗炎症性および抗線維性メカニズムであるが、肺損傷から保護する。 したがって、組換えアンジオテンシン変換酵素(ACE)の使用は、ウイルス受容体結合部位をブロックするだけでなく、肺保護を提供する。 SARS-CoV-2がACE2に結合するシナリオでは、保護ACEの結合はひどく減ります。, 肺胞細胞の破壊は、血液酸素化、肺線維症、浮腫、再生障害が続き、最終的には呼吸不全につながります(7)。
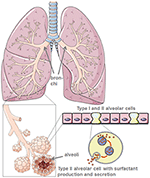
図1. 肺および肺胞形態のモデル。 肺界面活性剤は、II型肺胞細胞によって産生される。 https://creativecommons.org/licenses/by/3.0/の下でスマートservier医療アートを使用して作成されました。,
防御抗炎症ARDS療法としての肺界面活性剤
呼吸不全は、また、期間生まれの子供と比較して肺界面活性剤の産生が減少した早産児において、全く異なる起源から知られている。 十分な肺サーファクタントがなければ、呼気中に肺胞が崩壊し、血液酸素化が不十分になります。
肺表面は、空気-液体-間期を示し、内および呼気中に一定の運動をしている。 後者は、流体表面張力による組織崩壊のリスクを与える。, 肺は、その表面を肺界面活性剤で覆うことによってこの危険を克服する。 肺サーファクタントは、出生直後に肺サーファクタントを産生し始めるタイプII肺胞細胞である、末端肺枝に見られる特殊な細胞で産生される(8)。
肺界面活性剤は、リン脂質と四つの界面活性剤蛋白質(SP)、すなわち親水性SP-AおよびSP-D、コレクチンとも呼ばれ、親油性SP-BおよびSP-C(9)の混合物である。 肺界面活性剤は表面張力を低下させ、それによって呼気中の肺胞崩壊を防止する。, すべてのSPは肺の自然免疫応答に寄与し、SP-BおよびSP-Cはリン脂質に富む界面活性剤の一貫性にも影響する(10)。 最近、新規界面活性剤関連タンパク質(SFTA)は、”古典的な”SP(11-13)と比較して同様の特性を有する記載された。 SFTA2は親水性であり、SP-AおよびSP-D(13)と比較される同じような特性を表示します。 SFTA3は、マクロファージ細胞株(14)の食作用を増強し、両親媒性タンパク質(12)である。, したがって、それは動物の肺の市販の親油性抽出に存在する可能性が高く、CoV-2に対するマクロファージの貪食活性を高めることができる。
早産児では、肺サーファクタントの産生は不十分であり、血液酸素処理が不十分であり、肺胞表面張力が高く、炎症反応が増加する。未熟児におけるARDSの治療法として,気管支洗浄由来の外因性ウシまたはブタ肺界面活性剤が確立された。, 肺サーファクタント製剤による治療は、酸素化の強化および生存の増加をもたらす(15-17)。 注目すべきは、天然に存在する肺界面活性剤による治療は、合成肺界面活性剤(と比較して幼児の生存に関して良好な結果を有していた17)。 天然の肺界面活性剤は、肺胞マクロファージの活性を調節し、炎症を軽減する脂質(90%)および界面活性剤タンパク質(10%)の混合物である。 親油性肺界面活性剤フラクションは、肺(18)に気管内に適用されたときだけでなく、皮膚(19)上に局所的に適用されたときに抗炎症特性を有する。, 皮膚において、肺界面活性剤は、in vivoで創傷における炎症促進遺伝子および線維化促進遺伝子の発現を減少させる。 様々なin vitroおよびin vivoマウスおよび創傷炎症のヒトモデルにおいて、肺界面活性剤はTNF-α、TACEおよびIL-6(19)を減少させ、これらは深刻な影響を受けたCOVID-19
最近の知見は、SARS-CoV-2がCOVID-19関連肺炎におけるII型肺胞細胞の破壊を誘導することを示している(2)。 正確にそれらの細胞は肺界面活性剤を産生し、肺の崩壊を防ぎます。, さらに、サイトカインの大量放出を伴うリンパ球減少症は、COVID-19患者の重度の症例における肺不全および死亡につながる別の要因である。 したがって、抗TNFおよび抗IL-6などの抗炎症標的は、重度のCOVID-19感染をより良好に制御することが示唆されている(20)。,
ディスカッション:COVID-19肺炎患者における肺関門修復のための肺界面活性剤の使用
肺界面活性剤の治療は、ARDSを有する新生児のための標準、非常に安全かつ効果的な治療法であるが、組換えSP-Cベースの界面活性剤による治療は、成人の主要な無作為化比較試験で改善された生存を示さなかった(18)。 重要なことに、天然界面活性剤の使用は、合成界面活性剤(16、17)と比較して有利であると思われ、血液酸素化および乳児における換気時間の短縮(16)。, 胎便吸引症候群はcovid-19肺炎に似ており、界面活性剤産生およびII型肺胞細胞の破壊が減少している(21)。 天然肺界面活性剤の早期投与は、ECMO療法および換気時間を減少させた(21)。 このことは,天然肺サーファクタントの早期投与が重症ARDSの成人患者においても肺機能を改善できることを示唆しているが,死因は虚脱肺だけではなく多臓器不全である可能性がある。, その上、ARDSの開発のための異なった危険率および異なった表現型は治療上の手段による可能なさまざまな効果を意味します。 したがって、COVID-19関連ARDS患者におけるサーファクタント療法の有益な効果は、特に肺不全に対する治療戦略の早期に適用された場合に考えられる。,
堅牢な抗炎症性および肺保護効果と肺支持療法のための今日の緊急の必要性のために、我々はARDS集中治療治療の現在の標準に加えて、天然肺界面 現在の証拠は、これが血液酸素化を増加させ、肺浮腫を減少させ、COVID-19患者の肺解剖で見られる過剰な炎症反応を改善することを示唆している(22)。, Windtree therapeutics™は、合成界面活性剤であるKL4を重度のCOVID-19感染患者(https://www.windtreetx.com/)で試験する計画を発表しました。 ドイツでは、Lyomark Pharma GmbHは、肺炎を有する成人COVID-19患者においても、天然の多成分肺界面活性剤bovactantを試験する予定である(www.lyomark.com市販の肺界面活性剤は、ICU規格に対して比較的安価であり、容易に入手可能であり、小児および成人において既知の副作用を有さない。
, 肺界面活性剤は、主にウシ(bovactant、Alveofact®)またはブタ(poractant alfa、Curosurf®)の肺から洗浄または組織ミンチングによって採取され、その後脂質画分が抽出されるため、ウシまたはブタ製品に対する既知のアレルギーを有する患者には注意が必要である。
投与は、換気された患者の気管チューブに再構成された凍結乾燥物を加えることによって、肺胞腔に薬物を直接送達することによって簡単である。 Bovactantに関しては、噴霧器はFDAによって米国の臨床使用のために最近承認されました。, 肺胞の外面を覆うことによって、肺サーファクタントは炎症細胞に直接作用し、サイトカイン産生および組織破壊を減少させる。 それによって、それは肺関門を回復させ、したがって肺の崩壊を防止する(図2)。 その結果、それは換気療法の持続期間を減らし、呼吸を促進し、そしてこうして患者の回復に貢献します。
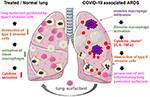
図2. 重度のCOVID-19関連ARDSにおける肺保護のための外部適用肺サーファクタントの仮説的なメカニズム。, COVID-19関連ARDSは、大規模なマクロファージ浸潤、組織肺胞マクロファージ活性化および肺におけるサイトカイン産生の増強(サイトカイン”嵐”)によって特徴付けられ、ii型肺胞細胞を産生する界面活性剤の破壊につながり、抗炎症性、抗線維性肺界面活性剤の喪失によって状況を悪化させる。 外因性の界面活性剤は発火を減らし、こうして肺の存続を元通りにするかも https://creativecommons.org/licenses/by/3.0/の下でスマートservier医療アートを使用して作成されました。,
著者の貢献
すべての著者が原稿のデザイン、執筆、概念化に貢献しました。 UMとKMは数字を編集し、設計しました。
利益相反
著者らは、この研究は、潜在的な利益相反と解釈され得る商業的または財政的関係がない場合に行われたと宣言している。
謝辞
私たちは、この原稿を書く際の彼女の洞察力のあるサポートのためのDesiree Schumann(バーゼル大学)に感謝したいと思います。, 著者は、ドイツ研究財団(DFG)とJDRFによってサポートされています。 お掛けしない引用して多くの重要な出版物のページにアクセスは限界がある。
9. Bernhard W.肺界面活性剤:発達および呼吸生理学の文脈における機能および組成。 アン-アナット (2016) 208:146–50. 土井:10.1016/j.aanat.2016.08.003
PubMed Abstract|CrossRef Full Text|Google Scholar
10. ライト-ジュニア, 肺界面活性剤の”知恵”:宿主防御と表面張力低減機能のバランスをとる。 Am J Physiol肺細胞Mol Physiol. (2006)291:L847-50. 土井:10.1152/ajplung.00261.2006
PubMed Abstract|CrossRef Full Text|Google Scholar
11. Schicht M,Garreis F,Hartjen N,Beileke S,Jacobi C,Sahin A,et al. SFTA3-眼表面の新規界面活性剤タンパク質と角膜創傷治癒および涙膜表面張力におけるその役割。 2018年8月時点で9791位であった。 土井:10,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., 呼吸窮迫症候群を有する早産児および急性RDSを有する短期または長期の新生児におけるラマナサンR.サーファクタント療法。 Jペリナトール 2006年(平成26年) 1):S51-6;議論S63-4. doi:10.1038/sj.jp.7211474
PubMed Abstract|CrossRef Full Text|Google Scholar
16. ツィンマーマンLJさん、お疲れ様でした。 何が界面活性剤の新しいですか? 新生児学および小児科の最近の開発の臨床図。 ユーロピアン-ジャイアンツ所属。 (2007) 166:889–99. 土井:10,1007/00431-007-0501-4
PubMed Abstract|CrossRef Full Text|Google Scholar
17. Ainsworth SB,Beresford MW,Milligan DW,Shaw NJ,Matheus JN,Fenton AC,et al. 妊娠25-29週で生まれた新生児における呼吸窮迫症候群の治療のためのPumactantおよびporactant alfa:無作為化試験。 ランセット (2000) 355:1387–92. 土井:10,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar