Introduzione
Il virus corona SARS-CoV-2 si è già diffuso in tutto il mondo ed è attualmente, senza vaccino ancora disponibile, inarrestabile. Come da oggi, COVID-19 colpisce più di 3.000.000 pazienti confermati a livello globale. I farmaci di prima linea sono farmaci antivirali e sono in corso molteplici studi clinici urgenti., Tuttavia, un recente studio clinico che ha testato l’associazione di inibitori della proteasi dell’HIV lopinavir e ritonavir non ha mostrato alcuna significativa attività antivirale contro SARS-CoV-2 in pazienti con malattia grave (1). Finché non abbiamo terapie antivirali specifiche contro la SARS-CoV-2, dobbiamo fornire terapie sintomatiche di supporto per prevenire l’insufficienza polmonare, la causa più comune di mortalità COVID-19.,
Le cellule alveolari di tipo II Sono danneggiate dall’infezione virale SARS-COV-2
e la conseguente distruzione delle cellule alveolari attira le cellule immunitarie con un’eccessiva reazione infiammatoria alveolare essudativa e interstiziale. Una tempesta di produzione di citochine e chemochine provoca la distruzione del tessuto polmonare e, infine, nella sindrome da distress respiratorio acuto grave (ARDS). SARS-CoV-2 così come SARS-CoV entrano nelle cellule attraverso il recettore dell’enzima di conversione dell’angiotensina 2 (ACE2)., ACE2 è altamente espresso sulla superficie apicale degli epiteli delle vie aeree, endotelia vascolare, renale e tessuto cardiovascolare, nonché varie altre cellule (2). Quando entrano attraverso il tratto respiratorio, SARS-CoV e SARS-CoV-2 possono distruggere specificamente le cellule, che esprimono prevalentemente il recettore ACE2 sulle loro superfici, vale a dire le cellule alveolari di tipo II (2, 3).
Come cellule progenitrici dell’epitelio alveolare, le cellule alveolari di tipo II sono il “difensore dell’alveolo” (4)., Mantengono l’omeostasi alveolare, specialmente dopo il danno polmonare microbico, dove controllano la risposta infiammatoria.
Attraverso la loro produzione del tensioattivo polmonare protettivo, le cellule alveolari di tipo II riducono la tensione superficiale polmonare e quindi facilitano la respirazione e lo scambio di gas e, inoltre, sono centrali per i processi di riparazione dopo il trauma (5) (Figura 1). Il danno alle cellule alveolari di tipo II riduce drasticamente la produzione e la secrezione di tensioattivo polmonare nello spazio alveolare., Questa è seguita da atelettasia dovuta a disfunzione tensioattiva polmonare che riduce ulteriormente la compliance polmonare (6). L’interfase aria-liquido è perturbato nei pazienti infetti da SARS-CoV-2 che portano a danni polmonari. ACE2 si protegge da lesioni polmonari anche se i meccanismi anti-infiammatori e anti-fibrotici. Pertanto, l’uso dell’enzima di conversione dell’angiotensina ricombinante (ACE) non solo bloccherebbe i siti di legame del recettore del virus, ma fornirebbe anche protezione polmonare. Nello scenario in cui SARS-CoV-2 si lega a ACE2, il legame protettivo ACE è gravemente ridotto., La distruzione delle cellule alveolari è seguita da una ridotta ossigenazione del sangue, fibrosi polmonare, edema, rigenerazione alterata e, infine, porta a insufficienza respiratoria (7).
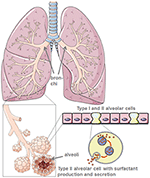
Figura 1. Modello di morfologia polmonare e alveolare. Il tensioattivo polmonare è prodotto da cellule alveolari di tipo II. Creato utilizzando smart servier medical art sotto https://creativecommons.org/licenses/by/3.0/.,
Tensioattivo polmonare come terapia protettiva anti-infiammatoria ARDS
L’insufficienza respiratoria è nota anche da un’origine completamente diversa, in particolare nei neonati pretermine con ridotta produzione di tensioattivo polmonare rispetto ai bambini nati a termine. Senza tensioattivo polmonare sufficiente, gli alveoli collassano durante l’espirazione con conseguente scarsa ossigenazione del sangue.
Le superfici polmonari raffigurano l’interfase aria-liquido e sono in costante movimento durante l’in-e l’espirazione. Quest’ultimo conferisce il rischio di collasso del tessuto a causa della tensione superficiale del fluido., Il polmone supera questo pericolo coprendo la sua superficie con tensioattivo polmonare. Il tensioattivo polmonare è prodotto in cellule specializzate presenti nei rami polmonari terminali, cellule alveolari di tipo II, che iniziano a produrre tensioattivo polmonare immediatamente dopo la nascita (8).
Il tensioattivo polmonare è una miscela di fosfolipidi e quattro proteine tensioattive (SP), vale a dire l’idrofilo SP-A e SP-D, chiamato anche collectine, e il lipofilo SP-B e SP-C (9). Il tensioattivo polmonare abbassa la tensione superficiale e quindi impedisce il collasso alveolare durante l’espirazione., Tutte le SP contribuiscono alle risposte immunitarie innate del polmone mentre SP – B e SP-C influenzano anche la consistenza del tensioattivo ricco di fosfolipidi (10). Recentemente, nuove proteine associate al tensioattivo (SFTA) sono state descritte con proprietà simili rispetto alla “classica” SP (11-13). SFTA2 è idrofilo e mostra proprietà simili rispetto a SP-A e SP-D (13). SFTA3 migliora la fagocitosi delle linee cellulari dei macrofagi (14) ed è una proteina anfifilica (12)., Pertanto, è probabile che sia presente nelle estrazioni lipofile disponibili in commercio dei polmoni animali e potrebbe migliorare l’attività fagocitotica dei macrofagi contro CoV-2.
Nei neonati pretermine, la produzione di tensioattivo polmonare è insufficiente con scarsa ossigenazione del sangue e alta tensione superficiale alveolare che porta ad un aumento della reazione infiammatoria.
A partire dalla fine degli anni settanta, il tensioattivo polmonare esogeno bovino o suino derivato dal lavaggio bronchiale è stato stabilito con successo come terapia per ARDS nei neonati prematuri., Il trattamento con preparati tensioattivi polmonari porta ad una maggiore ossigenazione e ad una maggiore sopravvivenza (15-17). Da notare che il trattamento con tensioattivo polmonare presente in natura ha avuto un esito migliore per quanto riguarda la sopravvivenza infantile rispetto al tensioattivo polmonare sintetico (17). I tensioattivi polmonari naturali sono una miscela di lipidi (90%) e proteine tensioattive (10%) che regolano l’attività dei macrofagi alveolari e riducono l’infiammazione. La frazione lipofila del tensioattivo polmonare ha proprietà antinfiammatorie se applicata intratrachealmente al polmone (18) e localmente sulla pelle (19)., Nella pelle, il tensioattivo polmonare riduce l’espressione di geni pro-infiammatori e pro-fibrotici nelle ferite in vivo. In vari modelli murini e umani in vitro e in vivo di infiammazione della ferita, il tensioattivo polmonare ha ridotto il TNF-α, il TACE e IL-6 (19), che sono altamente elevati nei pazienti con COVID-19 gravemente colpiti.
Recenti scoperte mostrano che SARS-CoV-2 induce la distruzione delle cellule alveolari di tipo II nella polmonite associata a COVID-19 (2). Esattamente quelle cellule producono tensioattivo polmonare e prevenire il collasso polmonare., Inoltre, la linfocitopenia con rilascio massiccio di citochine è un altro fattore che porta all’insufficienza polmonare e alla morte nei casi gravi di pazienti con COVID-19. Pertanto, sono stati suggeriti obiettivi anti-infiammatori come anti-TNF e anti-IL-6 per controllare meglio l’infezione grave da COVID-19 (20).,
Discussione: l’uso del tensioattivo polmonare per il ripristino della barriera polmonare in pazienti con polmonite da COVID-19
Sebbene la terapia con tensioattivo polmonare sia la terapia standard, molto sicura ed efficace per i neonati con ARDS, il trattamento con tensioattivo ricombinante a base di SP-C non ha mostrato un miglioramento della sopravvivenza nei principali studi randomizzati controllati negli adulti (18). È importante sottolineare che l’uso di tensioattivi naturali sembra essere vantaggioso rispetto ai tensioattivi sintetici (16, 17) con un significativo miglioramento dell’ossigenazione del sangue e un tempo di ventilazione più breve nei neonati (16)., La sindrome da aspirazione del meconio assomiglia alla polmonite COVID-19 con ridotta produzione di tensioattivo e distruzione delle cellule alveolari di tipo II (21). La somministrazione precoce di tensioattivo polmonare naturale ha ridotto la terapia con ECMO e il tempo di ventilazione (21). Ciò suggerisce che la somministrazione precoce di tensioattivo polmonare naturale potrebbe effettivamente migliorare la funzione polmonare anche nei pazienti adulti con ARDS grave, mentre la causa della morte potrebbe non essere il polmone collassato da solo, ma piuttosto un fallimento multi-organo., Inoltre, diversi fattori di rischio per lo sviluppo di ARDS e diversi fenotipi implicano possibili effetti variabili dovuti alle misure terapeutiche. Pertanto, gli effetti benefici della terapia tensioattiva nei pazienti con ARDS associati a COVID-19 sono concepibili, specialmente se applicati all’inizio della strategia di trattamento contro l’insufficienza polmonare.,
A causa della robusta efficacia antinfiammatoria e protettiva del polmone e dell’urgente necessità odierna di terapia di supporto polmonare, proponiamo il trattamento adiuvante dei pazienti affetti da polmonite COVID-19 in terapia intensiva con tensioattivi polmonari naturali in aggiunta all’attuale standard di trattamento di terapia intensiva ARDS. Le prove attuali suggeriscono che ciò aumenterebbe l’ossigenazione del sangue, ridurrebbe l’edema polmonare e migliorerebbe l’eccessiva reazione infiammatoria riscontrata nelle autopsie polmonari dei pazienti con COVID-19 (22)., Windtree therapeutics™ ha annunciato il suo piano per testare KL4, un tensioattivo sintetico, in pazienti affetti da COVID-19 gravi (https://www.windtreetx.com/). In Germania, Lyomark Pharma GmbH sta progettando di testare il loro tensioattivo polmonare multicomponente naturale bovactant anche in pazienti adulti COVID-19 con polmonite (www.lyomark.com).
Il tensioattivo polmonare disponibile in commercio è relativamente economico per gli standard ICU, facilmente disponibile e non ha effetti collaterali noti nei bambini e negli adulti., Si deve prestare attenzione nei pazienti con allergie note contro i prodotti bovini o suini, poiché i tensioattivi polmonari vengono per lo più raccolti da polmoni bovini (bovactant, Alveofact®) o suini (poractant alfa, Curosurf®) mediante lavaggio o macinazione dei tessuti seguita dall’estrazione della frazione lipidica.
La somministrazione è semplice aggiungendo il liofilizzato ricostituito nel tubo tracheale del paziente ventilato che consegna il farmaco direttamente nello spazio alveolare. Per quanto riguarda bovactant, un nebulizzatore è stato recentemente approvato per uso clinico negli Stati Uniti dalla FDA., Coprendo la superficie esterna degli alveoli, il tensioattivo polmonare agisce direttamente sulle cellule infiammatorie riducendo la produzione di citochine e la distruzione dei tessuti. In tal modo, ripristina la barriera polmonare e quindi impedisce il collasso polmonare (Figura 2). Di conseguenza, ridurrà la durata della terapia di ventilazione, faciliterà la respirazione e quindi contribuirà al recupero dei pazienti.
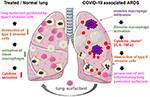
Figura 2. Meccanismo ipotetico di tensioattivo polmonare applicato esternamente per la protezione polmonare in ARDS associato a COVID-19 grave., COVID-19 associato ARDS è caratterizzata da massiccia infiltrazione dei macrofagi, attivazione dei macrofagi alveolari del tessuto e un potenziamento della produzione di citochine nel polmone (citochina “tempesta”), che porta alla distruzione del tensioattivo producendo cellule alveolari di tipo II, che peggiora la situazione attraverso la perdita di tensioattivo polmonare antinfiammatorio e anti-fibrotico. Il tensioattivo esogeno può ridurre l’infiammazione e quindi ripristinare la sopravvivenza polmonare. Creato utilizzando smart servier medical art sotto https://creativecommons.org/licenses/by/3.0/.,
Contributi dell’autore
Tutti gli autori hanno contribuito alla progettazione, scrittura e concettualizzazione del manoscritto. UM e KM curato e progettato le figure.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Ringraziamenti
Vorremmo ringraziare Desiree Schumann (Università di Basilea) per il suo supporto perspicace nella scrittura di questo manoscritto., Gli autori sono supportati dalla Fondazione tedesca per la ricerca (DFG) e JDRF. Ci scusiamo per non aver citato molte pubblicazioni importanti a causa di limitazioni di spazio.
9. Bernhard W. Tensioattivo polmonare: funzione e composizione nel contesto dello sviluppo e fisiologia respiratoria. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract | CrossRef Full Text/Google Scholar
10. Wright JR., La “saggezza” del tensioattivo polmonare: bilanciamento della difesa dell’ospite e delle funzioni di riduzione della tensione superficiale. Am J Physiol Cellula polmonare Mol Physiol. (2006)291: L847-50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstract | CrossRef Full Text/Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-una nuova proteina tensioattiva della superficie oculare e il suo ruolo nella guarigione della ferita corneale e nella tensione superficiale del film lacrimale. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Terapia tensioattiva nei neonati pretermine con sindrome da distress respiratorio e nei neonati a breve termine o a termine con RDS acuto. Perinatolo. (2006) 26 (Suppl. 1): S51–6; discussione S63-4. doi: 10.1038 / sj. jp.7211474
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Stato JV, Zimmermann LJ. Cosa c’è di nuovo in tensioattivo? Una visione clinica sui recenti sviluppi in neonatologia e pediatria. Europ J Pediatria. (2007) 166:889–99. doi: 10.,1007 / s00431-007-0501-4
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumactant e poractant alfa per il trattamento della sindrome da distress respiratorio in neonati nati a 25-29 settimane di gestazione: uno studio randomizzato. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar