Chimica unica degli elementi più leggeri
La chimica dell’elemento del secondo periodo di ciascun gruppo (n = 2: Li, Be, B, C, N, O e F) differisce per molti aspetti importanti da quella dei membri più pesanti, o congeneri, del gruppo. Di conseguenza, gli elementi del terzo periodo (n = 3: Na, Mg, Al, Si, P, S e Cl) sono generalmente più rappresentativi del gruppo a cui appartengono., La chimica anomala degli elementi del secondo periodo deriva da tre caratteristiche importanti: piccoli raggi, orbitali d energeticamente non disponibili e una tendenza a formare legami pi (π) con altri atomi.
In contrasto con la chimica degli elementi del secondo periodo, la chimica degli elementi del terzo periodo è più rappresentativa della chimica del rispettivo gruppo.
A causa dei loro piccoli raggi, gli elementi del secondo periodo hanno affinità di elettroni meno negative di quanto sarebbe previsto dalle tendenze periodiche generali., Quando un elettrone viene aggiunto a un atomo così piccolo, l’aumento delle repulsioni elettrone–elettrone tende a destabilizzare l’anione. Inoltre, le piccole dimensioni di questi elementi impediscono loro di formare composti in cui hanno più di quattro vicini più vicini. Quindi BF3 forma solo lo four BF4 tetraedrico a quattro coordinate, mentre nelle stesse condizioni AlF3 forma lo AlF AlF63 ottaedrico a sei coordinate. A causa delle dimensioni atomiche più piccole, i composti ionici binari semplici degli elementi del secondo periodo hanno anche un carattere covalente maggiore rispetto ai composti corrispondenti formati dai loro congeneri più pesanti., I cationi molto piccoli derivati da elementi del secondo periodo hanno un elevato rapporto carica-raggio e possono quindi polarizzare il guscio di valenza riempito di un anione. Come tale, il legame in tali composti ha una componente covalente significativa, dando le proprietà dei composti che possono differire significativamente da quelle previste per i composti ionici semplici. Ad esempio, LiCl, che è parzialmente covalente, è molto più solubile di NaCl in solventi con una costante dielettrica relativamente bassa, come l’etanolo (ε = 25,3 contro 80,1 per H2O).,
Poiché gli orbitali d non sono mai occupati per i numeri quantici principali inferiori a 3, gli elettroni di valenza degli elementi del secondo periodo occupano solo gli orbitali 2s e 2p. L’energia degli orbitali 3d supera di gran lunga l’energia degli orbitali 2s e 2p, quindi usarli nel legame è energeticamente proibitivo. Di conseguenza, le configurazioni di elettroni con più di quattro coppie di elettroni attorno a un elemento centrale del secondo periodo non vengono semplicemente osservate. Potresti ricordare che il ruolo degli orbitali d nel legame nei composti del gruppo principale con numeri di coordinazione di 5 o superiori rimane alquanto controverso., Infatti, descrizioni teoriche del legame in molecole come SF6 sono state pubblicate senza menzionare la partecipazione di orbitali d sullo zolfo. Gli argomenti basati sulla disponibilità d-orbitale e sulla piccola dimensione dell’atomo centrale, tuttavia, prevedono che i numeri di coordinazione maggiori di 4 siano insoliti per gli elementi del secondo periodo, che è in accordo con i risultati sperimentali.,
Una delle differenze più drammatiche tra gli elementi del gruppo principale più leggeri e i loro congeneri più pesanti è la tendenza degli elementi del secondo periodo a formare specie che contengono legami multipli. Ad esempio, N è appena sopra P nel gruppo 15: N2 contiene un legame N N N, ma ogni atomo di fosforo in P4 tetraedrico forma tre legami P–P. Questa differenza di comportamento riflette il fatto che all’interno dello stesso gruppo della tavola periodica, le energie relative del legame π e del legame sigma (σ) differiscono. Un legame C=C, ad esempio, è circa l ‘ 80% più forte di un legame C–C., Al contrario, un legame Si = Si, con meno sovrapposizione p-orbitale tra gli orbitali di valenza degli atomi legati a causa della dimensione atomica più grande, è solo circa il 40% più forte di un legame Si–Si. Di conseguenza, i composti che contengono sia legami multipli che singoli da C a C sono comuni per il carbonio, ma i composti che contengono solo legami sigma Si–Si sono più energeticamente favorevoli per il silicio e gli altri elementi del terzo periodo.,
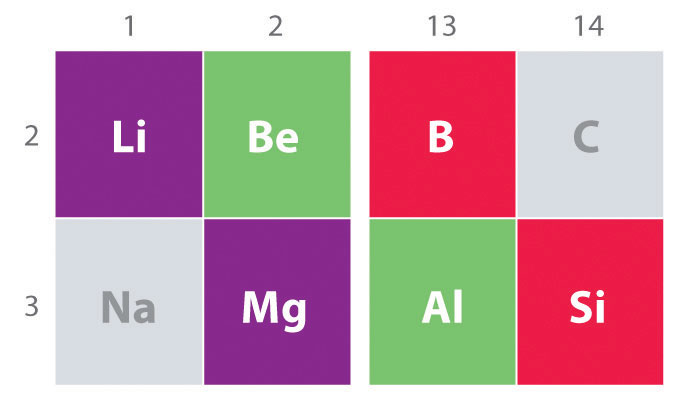
un’Altra tendenza importante notare che nel gruppo principale di chimica la chimica è la somiglianza tra l’elemento più leggero di un gruppo e l’elemento immediatamente al di sotto e a destra nel gruppo successivo, un fenomeno noto come la diagonale effetto (Figura \(\PageIndex{2}\)) Ci sono, per esempio, delle notevoli somiglianze tra la chimica di Li e Mg, Essere e Al e B e Si. Sia BeCl2 che AlCl3 hanno un carattere covalente sostanziale, quindi sono in qualche modo solubili in solventi organici non polari., Al contrario, sebbene Mg e Be siano nello stesso gruppo, MgCl2 si comporta come un tipico alogenuro ionico a causa dell’elettronegatività inferiore e delle dimensioni maggiori del magnesio.