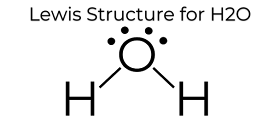
készítette: MakeTheBrainHappy.
A H2O Lewis Dot szerkezete számos egyedi tulajdonságot ad neki, elsősorban a központi oxigénatom két magányos párja miatt. Ez növeli az elektron-elektron repulziót, ezért hajlított szerkezetet hoz létre, szemben a CO2 lineáris szerkezetével. Ez a “hajlított” molekuláris szerkezet számos egyedi tulajdonságot ad, például poláris., Az egyik legérdekesebb jelenség a “hidrogénkötés” gondolata, amely drámaian befolyásolja a víz tulajdonságait.
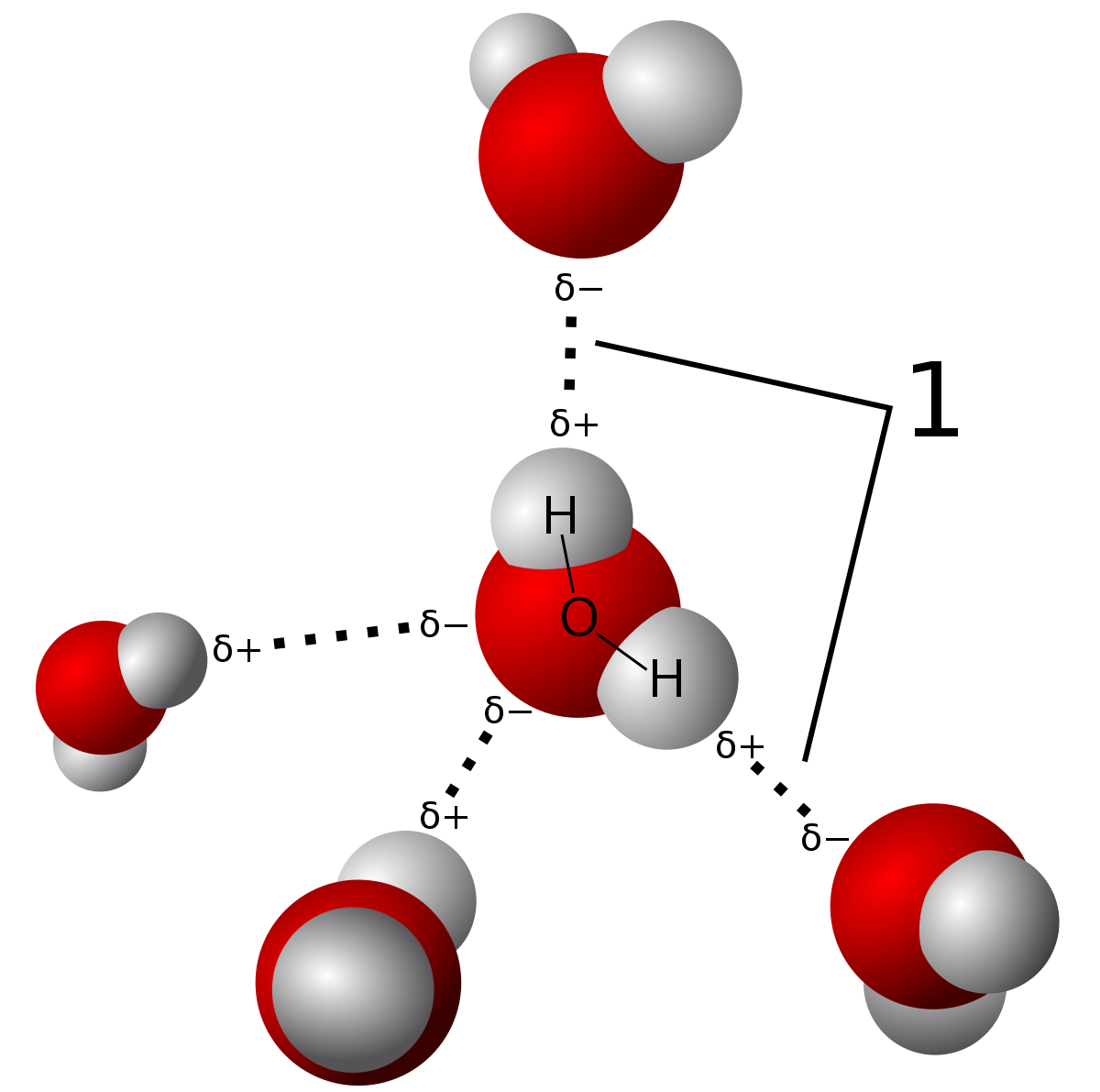
a hidrogénkötés egyfajta intermolekuláris erő, ahol az oxigénatom elektronegativitási különbsége részleges állandó dipólust képez a hidrogén és az oxigénatomok között (a szaggatott vonalakban látható). Maguk a vízmolekulák kötései kovalens kötések. Meg lehet tanulni a különbség ebben a bejegyzésben., Forrás
ezeknek a hidrogénkötéseknek az erőssége miatt a víz viszonylag magas olvadás-és forráspontú, bár nem olyan magas, mint a hálózati kovalens szilárd anyagok. Ezeket intramolekuláris erők kötik össze, amelyek magukban foglalják az elektronok tényleges megosztását, szemben a részleges dipólerőkkel hidrogénkötésekben. Csak háromféle kötés létezik, amelyek hidrogénkötéssel rendelkeznek. Ezek N-H, O-H és F-H kötések a molekulák közötti nagy elektronegativitási különbségek miatt.,
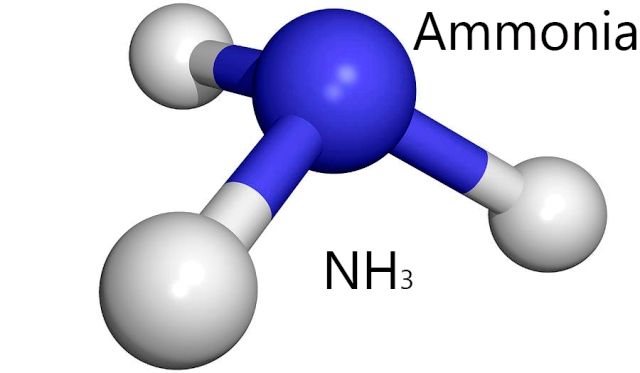
NH3 egy másik molekula, amely hasonló hidrogénkötéseket hoz létre, mint a H2O. forrás
milyen más tulajdonságokkal rendelkezik a víz?
A Víz az egyetlen olyan elem, amely a földön természetesen megtalálható mindhárom állapotban (szilárd, folyékony és gáz halmazállapotú). A hidrogénkötés kristályos szerkezetet eredményez, ami kevésbé sűrű, mint a folyékony víz. Ezért jég úszik az óceánokban. A víz felületi feszültsége és tapadása is magas., A kohézió és az adhézió elengedhetetlen ahhoz, hogy azok a növények, akik manipulálják ezeket a folyamatokat, a gyökerektől a levelekig mozgatják a vizet, hogy támogassák a növény növekedését. Mindezt a H2O egyszerű szerkezete okozza, amelyet a fenti Lewis Dot Diagram képvisel.

vízmolekulák mindhárom anyagállapotban. Forrás