Bevezető
Corona vírus SARS koronavírus-2 már szerte az egész világon jelenleg nincs vakcina áll rendelkezésre, mégis, megállíthatatlan. A mai nap szerint a COVID-19 világszerte több mint 3 000 000 megerősített beteget érint. Az első vonalbeli gyógyszerek vírusellenes szerek, és több sürgős klinikai vizsgálat is folyamatban van., A lopinavir és a ritonavir HIV proteáz inhibitor kombinációját vizsgáló, nemrégiben elvégzett klinikai vizsgálat azonban nem mutatott szignifikáns vírusellenes hatást a SARS-CoV-2-vel szemben súlyos betegségben szenvedő betegeknél (1). Mindaddig, amíg nincs specifikus vírusellenes terápiánk a SARS-CoV-2 ellen, támogató tüneti terápiákat kell biztosítanunk a tüdőelégtelenség megelőzésére, amely a COVID-19 halálozás leggyakoribb oka.,
A II.típusú alveoláris sejteket a SARS-COV-2
vírusfertőzés károsítja, és az így létrejövő alveoláris sejtpusztulás túlzott alveoláris exudatív és interstitialis gyulladásos reakcióval vonzza az immunsejteket. A citokin és a kemokin termelődésének vihara tüdőszövet-pusztulást, végül súlyos akut légzési distressz szindrómát (ARDS) eredményez. A SARS-CoV-2, valamint a SARS-CoV az angiotenzin konvertáló enzimreceptor 2 (ACE2) révén jut be a sejtekbe., Az ACE2 erősen expresszálódik a légúti epithelia, a vaszkuláris endothelia, a vese és a kardiovaszkuláris szövet, valamint számos más sejt (2) apikális felületén. Ahogy belépnek a légutakon keresztül, a SARS-CoV és a SARS-CoV-2 kifejezetten elpusztíthatják a sejteket, amelyek túlnyomórészt az ACE2 receptort fejezik ki felületükön, nevezetesen a II.típusú alveoláris sejteket (2, 3).
az alveoláris epitélium progenitor sejtjeként a II. típusú alveoláris sejtek az alveolus védelmezői (4)., Fenntartják az alveoláris homeosztázist, különösen a mikrobiális tüdőkárosodás után, ahol szabályozzák a gyulladásos választ.
a termelés a védő tüdő felületaktív anyag, II-es típusú alveoláris sejteket, csökkenti a tüdő felületi feszültségét, ezáltal megkönnyítik a légzést, gáz exchange, továbbá, központi javítási folyamatok trauma után (5) (1.Ábra). A II. típusú alveoláris sejtek károsodása drasztikusan csökkenti a tüdő felületaktív anyag termelését és az alveoláris térbe történő szekréciót., Ezt követi az atelectasis a tüdő felületaktív diszfunkciója miatt, amely tovább csökkenti a tüdő megfelelőségét (6). A levegő-folyadék-interfázis zavarban van a SARS-CoV-2 fertőzött betegeknél, ami tüdőkárosodáshoz vezet. Az ACE2 maga is véd a tüdőkárosodástól, bár gyulladáscsökkentő és fibrotikus mechanizmusok. Így a rekombináns angiotenzin konvertáló enzim (ACE) alkalmazása nemcsak blokkolja a vírusreceptor kötőhelyeit, hanem tüdővédelmet is biztosít. Abban a forgatókönyvben, amikor a SARS-CoV-2 kötődik az ACE2-hez, a védő ACE kötés súlyosan csökken., Az alveoláris sejtek pusztulását a vér oxigénellátásának csökkenése, tüdőfibrózis, ödéma, regenerálódási zavar követi, és végső soron légzési elégtelenséghez vezet (7).
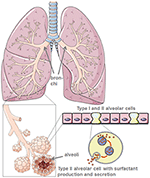
1.ábra. A tüdő-és alveoláris morfológia modellje. A tüdő felületaktív anyagot II-es típusú alveoláris sejtek állítják elő. A smart servier medical art használatával készült https://creativecommons.org/licenses/by/3.0/alatt.,
Tüdő Felületaktív anyag, mint Védő Gyulladáscsökkentő ARDS Terápia
Légzési elégtelenség is ismert, egy teljesen más eredetű, azaz a koraszülött csecsemők csökken a tüdő surfactant termelés képest kifejezés született gyermekek. Anélkül, hogy elegendő tüdő felületaktív anyag lenne, az alveolusok összeomlanak a kilégzés során, ami rossz véroxigenációt eredményez.
A Tüdőfelületek a levegő-folyadék-interfázist ábrázolják, és állandó mozgásban vannak a be – és kilégzés során. Ez utóbbi biztosítja a szövet összeomlásának kockázatát a folyadék felületi feszültsége miatt., A tüdő legyőzi ezt a veszélyt azáltal, hogy felületét tüdő felületaktív anyaggal borítja. A tüdő felületaktív anyagot a terminális tüdő ágakban, II. típusú alveoláris sejtekben található speciális sejtekben állítják elő,amelyek közvetlenül a születés után kezdik el előállítani a tüdő felületaktív anyagot (8).
a tüdő felületaktív anyag a foszfolipidek és négy felületaktív protein (SP) keveréke, nevezetesen a hidrofil SP-A és SP-d, más néven kollektinek, valamint a lipofil SP-B és SP-C (9). A tüdő felületaktív anyag csökkenti a felületi feszültséget, ezáltal megakadályozza az alveoláris összeomlást a kilégzés során., Minden SP hozzájárul a tüdő veleszületett immunválaszához, míg az SP-B és az SP-C befolyásolja a foszfolipidban gazdag felületaktív anyag konzisztenciáját is (10). A közelmúltban az új felületaktív anyaghoz kapcsolódó fehérjéket (SFTA) hasonló tulajdonságokkal írták le, mint a “klasszikus” SP (11-13). Az SFTA2 hidrofil, és hasonló tulajdonságokkal rendelkezik, mint az SP-A és az SP-D (13). Az SFTA3 fokozza a makrofág sejtvonalak fagocitózisát (14), és amfifil fehérje (12)., Ezért valószínűleg jelen van az állati tüdő kereskedelmi forgalomban kapható lipofil kivonataiban, és fokozhatja a makrofágok fagocitotikus aktivitását a CoV-2-vel szemben.
koraszülött csecsemőknél a tüdő felületaktív anyag termelése elégtelen a vér elégtelen oxigénellátásával és a magas alveoláris felületi feszültséggel, ami fokozott gyulladásos reakcióhoz vezet.
a hetvenes évek végétől kezdve az exogén szarvasmarhát vagy a hörgőmosásból származó sertés tüdő felületaktív anyagot sikeresen alkalmazták Ards terápiaként koraszülött csecsemőknél., A tüdő felületaktív készítményekkel történő kezelés fokozott oxigenizációhoz és fokozott túléléshez vezet (15-17). Megjegyzendő, hogy a természetben előforduló tüdő felületaktív anyaggal végzett kezelés jobb eredményt hozott a csecsemők túlélése tekintetében, mint a szintetikus tüdő felületaktív anyag (17). A természetes tüdő felületaktív anyagok lipidek (90%) és felületaktív fehérjék (10%) keveréke, amelyek szabályozzák az alveoláris makrofágok aktivitását és csökkentik a gyulladást. A lipofil tüdő felületaktív frakciója gyulladásgátló tulajdonságokkal rendelkezik, ha intratracheálisan alkalmazzák a tüdőre (18), valamint helyileg a bőrre (19)., A bőrben a tüdő felületaktív anyag csökkenti a pro-gyulladásos és Pro-fibrotikus gének expresszióját in vivo sebekben. A sebgyulladás különböző in vitro és in vivo Murin-és humán modelljeiben a tüdő felületaktív anyag csökkentette a TNF-α-t, a TACE-t és az IL-6-ot (19), amelyek a súlyosan érintett COVID-19 betegeknél nagyon magasak.
a legújabb eredmények azt mutatják, hogy a SARS-CoV-2 A II.típusú alveoláris sejtek pusztulását idézi elő a COVID-19 okozta tüdőgyulladásban (2). Pontosan ezek a sejtek termelnek tüdő felületaktív anyagot és megakadályozzák a tüdő összeomlását., Ezenkívül a citokinek tömeges felszabadulásával járó limfocitopénia egy másik tényező, amely a covid-19 betegek súlyos eseteiben tüdőelégtelenséghez és halálhoz vezet. Ezért gyulladáscsökkentő célokat, például anti-TNF-t és anti-IL-6-ot javasoltak a súlyos COVID-19 fertőzés jobb szabályozására (20).,
Vita: a Tüdő Felületaktív anyag a Légúti Akadály Helyreállítás a Betegek COVID-19 Tüdőgyulladás
Bár tüdő surfactant kezelés a standard, nagyon biztonságos, hatékony terápia újszülöttnek a ARDS, kezelés rekombináns SP-C alapú felületaktív anyag nem mutatott javuló túlélés a fő randomizált, kontrollált vizsgálatok a felnőttek (18). Fontos szempont, hogy a természetes felületaktív anyagok használata előnyösnek tűnik a szintetikus felületaktív anyagokhoz (16, 17) képest, a vér oxigénellátásának jelentős javulásával és a csecsemők rövidebb szellőzési idejével (16)., A Meconium aspirációs szindróma hasonlít a COVID-19 tüdőgyulladásra, csökkent felületaktív anyag termeléssel és II. típusú alveoláris sejtek pusztulásával (21). A természetes tüdő felületaktív anyag korai alkalmazása csökkentette az ECMO-kezelést és a szellőztetési időt (21). Ez arra utal, hogy a természetes tüdő felületaktív anyag korai alkalmazása valóban javíthatja a tüdőfunkciót súlyos ARDS-ben szenvedő felnőtt betegeknél is, míg a halál oka nem az összeomlott tüdő önmagában, hanem inkább több szervi elégtelenség., Emellett az ARDS kialakulásának különböző kockázati tényezői, valamint a különböző fenotípusok a terápiás intézkedések miatt változó hatásokat eredményeznek. Így elképzelhető a felületaktív anyag terápia jótékony hatása a COVID-19 társult ARDS-betegekben, különösen akkor, ha a pulmonalis elégtelenség elleni kezelési stratégia korai szakaszában alkalmazzák.,
a robusztus gyulladáscsökkentő és tüdővédő hatás, valamint a tüdőtámogató terápia mai sürgős szükségessége miatt javasoljuk a COVID-19 tüdőgyulladásban szenvedő betegek természetes tüdő felületaktív anyagokkal történő adjuváns kezelését az ARDS intenzív ellátás jelenlegi standardja mellett. A jelenlegi bizonyítékok arra utalnak, hogy ez növelné a vér oxigenizációját, csökkentené a tüdőödémát, és enyhítené a COVID-19 betegek tüdő-boncolásában talált túlzott gyulladásos reakciót (22)., A Windtree therapeutics™ bejelentette a KL4, egy szintetikus felületaktív anyag tesztelését súlyos COVID-19 fertőzött betegekben (https://www.windtreetx.com/). Németországban a Lyomark Pharma GmbH azt tervezi, hogy teszteli természetes többkomponensű tüdő felületaktív bovaktánsát felnőtt covid-19 tüdőgyulladásban szenvedő betegeknél is (www.lyomark.com).
a kereskedelemben kapható tüdő felületaktív anyag viszonylag olcsó az ICU szabványoknak megfelelően, könnyen hozzáférhető, és nincs ismert mellékhatása gyermekeknél és felnőtteknél., Óvatosan kell eljárni a szarvasmarha-vagy sertéstermékekkel szembeni ismert allergiában szenvedő betegeknél, mivel a tüdő felületaktív anyagait többnyire szarvasmarhafélékből (bovactant, Alveofact®) vagy sertésből (poractant alfa, Curosurf®) nyerik ki mosással vagy szövetdarabolással, majd a lipidfrakció kivonásával.
Az alkalmazás egyszerű, ha a feloldott liofilizátumot a szellőztetett beteg légcsőbe adja, amely a gyógyszert közvetlenül az alveoláris térbe szállítja. Ami a bovactantot illeti, az FDA nemrégiben jóváhagyta az USA-ban a klinikai felhasználásra szánt porlasztót., Az alveolusok külső felületének lefedésével a tüdő felületaktív anyag közvetlenül a citokintermelést és a szövetek pusztulását csökkentő gyulladásos sejtekre hat. Ezáltal visszaállítja a pulmonalis gátat, ezáltal megakadályozza a tüdő összeomlását (2.ábra). Következésképpen csökkenti a szellőzésterápia időtartamát, megkönnyíti a légzést, ezáltal hozzájárul a betegek gyógyulásához.
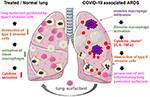
2.ábra. A külsőleg alkalmazott tüdő felületaktív anyag hipotetikus mechanizmusa a tüdő védelmére súlyos COVID-19 társult ARDS-ben., COVID-19 kapcsolódó ARDS jellemzi hatalmas makrofág beszivárgás, szövet alveoláris makrofágok aktiválás egy felerősítése citokin termelés a tüdő (citokin “vihar”), amely ahhoz vezet, hogy a pusztítás a felületaktív anyag termelő típusú II. alveoláris sejtek, ami rontja a helyzetet, hogy a veszteség gyulladáscsökkentő, anti-fibrotikus tüdő felületaktív anyag. Az exogén felületaktív anyag csökkentheti a gyulladást, és ezáltal helyreállíthatja a tüdő túlélését. A smart servier medical art használatával készült https://creativecommons.org/licenses/by/3.0/alatt.,
szerzői hozzájárulások
minden szerző hozzájárult a kézirat tervezéséhez, írásához és koncepciójához. Um És KM szerkesztette és tervezte a számokat.
összeférhetetlenség
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
elismerések
szeretnénk megköszönni Desiree Schumann (University of Basel) neki éleslátó támogatást írásban ezt a kéziratot., A szerzőket a Német Kutatási Alapítvány (DFG) és a JDRF támogatja. Elnézést kérünk, hogy nem idézünk sok fontos kiadványt az űrkorlátozások miatt.
9. Bernhard W. Lung felületaktív anyag: funkció és összetétel a fejlődés és a légzés fiziológiája összefüggésében. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract / CrossRef teljes szöveg / Google Scholar
10. Wright JR., A tüdő felületaktív anyagának “bölcsessége”: a gazdaszervezet védelmi és felületi feszültségcsökkentő funkcióinak kiegyensúlyozása. Am J Physiol Tüdősejt Mol Physiol. (2006) 291:L847-50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-a szemfelszín újszerű felületaktív proteinje és szerepe a szaruhártya sebgyógyulásában és a könnyfilm felületi feszültségében. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Surfactant terápia koraszülötteknél légzési distressz szindrómával, valamint akut RDS-ben szenvedő, közeli vagy távú újszülötteknél. J Perinatol. (2006) 26 (Suppl. 1): S51-6; vita S63-4. doi: 10.1038 / sj.jp.7211474
PubMed Abstract / CrossRef teljes szöveg | Google Scholar
16. Volt JV, Zimmermann LJ. Mi újság a felületaktív anyagban? Klinikai kép a neonatológia és a gyermekgyógyászat legújabb fejleményeiről. Europ J Pediatrics. (2007) 166:889–99. doi: 10.,1007 / s00431-007-0501-4
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumaktáns és poraktáns alfa a 25-29 hetes vemhesség idején született újszülötteknél a légzési distressz szindróma kezelésére: randomizált vizsgálat. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar