Introdução
Corona vírus SARS-CoV-2 já se espalhou por todo o mundo e é, actualmente, com nenhuma vacina disponível ainda, imparável. Como por hoje, COVID-19 afeta mais de 3.000.000 pacientes confirmados globalmente. Medicamentos de primeira linha são medicamentos antivirais e vários ensaios clínicos urgentes estão em curso., No entanto, um ensaio clínico recente em doentes com doença grave (1) demonstrou que a associação de inibidores da protease do VIH lopinavir e ritonavir não demonstrou actividade antivírica significativa contra SARS-CoV-2. Desde que não tenhamos terapias antivirais específicas contra SARS-CoV-2, precisamos fornecer terapias sintomáticas de suporte para prevenir a insuficiência pulmonar, a causa mais comum de mortalidade COVID-19.,as células alveolares do tipo II são danificadas pela infecção Viral SARS-COV-2
e a destruição das células alveolares resultante atrai as células imunitárias com uma reacção inflamatória exsudativa alveolar e intersticial excessiva. Uma tempestade de produção de citocina e quimiocina resulta na destruição do tecido pulmonar e, em última análise, na grave síndrome de dificuldade respiratória aguda (SDRA). O SARS-CoV – 2, bem como o SARS-CoV, penetram nas células através do receptor 2 da enzima de conversão da angiotensina (ACE2)., O ACE2 é altamente expresso na superfície apical do epitélio das vias aéreas, endotélio vascular, tecido renal e cardiovascular, bem como várias outras células (2). Como eles entram através do trato respiratório, SARS-CoV, e SARS-CoV-2 podem especificamente destruir células, que expressam predominantemente o receptor ACE2 em suas superfícies, nomeadamente as células alveolares tipo II (2, 3).
Como células progenitoras para o epitélio alveolar, as células alveolares tipo II são o “defensor do alveolo” (4)., Eles mantêm homeostase alveolar, especialmente após lesão pulmonar microbiana, onde eles controlam a resposta inflamatória.através da produção do surfactante pulmonar Protector, as células alveolares tipo II reduzem a tensão da superfície pulmonar e, assim, facilitam a respiração e a troca de gases e, além disso, são centrais para os processos de reparação após trauma (5) (Figura 1). Os danos nas células alveolares tipo II reduzem drasticamente a produção e secreção de tensioactivos pulmonares no espaço alveolar., Esta é seguida por atelectase devido à disfunção tensioactivo pulmonar que reduz ainda mais a conformidade pulmonar (6). A interfase ar-líquido é perturbada em doentes infectados com SARS-CoV-2, provocando lesões pulmonares. O próprio ACE2 protege das lesões pulmonares através de mecanismos anti-inflamatórios e anti-fibróticos. Assim, a utilização da enzima de conversão da angiotensina recombinante (ECA) não só bloquearia os locais de ligação ao receptor do vírus como também proporcionaria protecção pulmonar. No cenário em que o SARS-CoV-2 Se liga ao ACE2, a ligação à ECA protectora é severamente reduzida., A destruição de células alveolares é seguida por uma oxigenação sanguínea reduzida, fibrose pulmonar, edema, regeneração deficiente e, em última análise, leva a insuficiência respiratória (7).
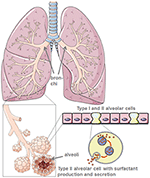
a Figura 1. Modelo de morfologia pulmonar e alveolar. O surfactante pulmonar é produzido por células alveolares tipo II. Criado usando arte médica inteligente servier sob https://creativecommons.org/licenses/by/3.0/.,
tensioactivo pulmonar como terapêutica anti-inflamatória protectora da ARDS
a insuficiência respiratória é também conhecida de uma origem inteiramente diferente, nomeadamente em lactentes pré-termo com produção reduzida de tensioactivos pulmonares em comparação com crianças nascidas a termo. Sem um surfactante pulmonar suficiente, os alvéolos colapsam durante a exalação, resultando numa oxigenação sanguínea fraca.as superfícies pulmonares retratam a interfase ar-líquido e estão em constante movimento durante a IN – e exalação. Este último confere o risco de colapso do tecido devido à tensão superficial do fluido., O pulmão supera este perigo, cobrindo a sua superfície com surfactante pulmonar. O surfactante pulmonar é produzido em células especializadas encontradas nos ramos pulmonares terminais, células alveolares tipo II, que começam a produzir surfactante pulmonar imediatamente após o nascimento (8).
tensioactivo pulmonar é uma mistura de fosfolípidos e quatro proteínas surfactantes( SP), nomeadamente o hidrofílico SP-A E SP-D, também chamados de colectinas, e o lipofílico SP-B E SP-C (9). O surfactante pulmonar reduz a tensão superficial, impedindo assim o colapso alveolar durante a exalação., Todos os SP contribuem para as respostas imunitárias inatas do pulmão, enquanto SP-B E SP-C influenciam também a consistência do surfactante rico em fosfolípidos (10). Recentemente, novas proteínas associadas ao surfactante (SFTA) foram descritas com propriedades semelhantes em comparação com o “classic” SP (11-13). O SFTA2 é hidrofílico e apresenta propriedades semelhantes às do SP-a e do SP-D (13). O SFTA3 aumenta a fagocitose das linhas celulares macrófagos (14) e é uma proteína anfifílica (12)., Por conseguinte, é provável que esteja presente nas extracções lipofílicas disponíveis no mercado dos pulmões animais e possa aumentar a actividade fagocitótica dos macrófagos contra o CoV-2.em lactentes pré-termo, a produção de tensioactivo pulmonar é insuficiente com uma oxigenação sanguínea fraca e uma tensão superficial alveolar elevada, conduzindo a uma reacção inflamatória aumentada.a partir do final da década de 70, o surfactante pulmonar exógeno de bovinos ou suínos, derivado da lavagem brônquica, foi estabelecido com sucesso como terapêutica para as DDR em lactentes prematuros., O tratamento com preparações tensioactivos pulmonares conduz a uma oxigenação reforçada e a um aumento da sobrevivência (15-17). Note-se que o tratamento com surfactante pulmonar de ocorrência natural teve um melhor resultado no que diz respeito à sobrevivência infantil em comparação com o surfactante pulmonar sintético (17). Os tensioactivos pulmonares naturais são uma mistura de lípidos (90%) e proteínas tensioactivos (10%) que regulam a actividade dos macrófagos alveolares e reduzem a inflamação. A fracção lipofílica do surfactante pulmonar tem propriedades anti-inflamatórias quando aplicada intratraquealmente no pulmão (18), bem como topicamente na pele (19)., Na pele, o surfactante pulmonar reduz a expressão de genes pró-inflamatórios e pró-fibróticos em feridas in vivo. Em vários modelos in vitro e in vivo de inflamação murina e humana de feridas, o surfactante pulmonar reduziu TNF-α, TACE e IL-6 (19), os quais são altamente elevados em doentes COVID-19 gravemente afectados.os resultados recentes mostram que a SARS-CoV-2 induz a destruição das células alveolares do tipo II em pneumonia associada à COVID-19 (2). Exactamente essas células produzem surfactante pulmonar e previnem o colapso pulmonar., Além disso, a linfocitopenia com libertação maciça de citoquinas é outro factor que conduz à insuficiência pulmonar e à morte em casos graves de doentes com COVID-19. Assim, foram sugeridos alvos anti-inflamatórios como anti-TNF e anti-IL-6 para melhor controlar a infecção grave do COVID-19 (20).,discussão: a utilização de tensioactivo pulmonar para recuperação da barreira pulmonar em doentes com Pneumonia COVID-19
embora a terapêutica com tensioactivo pulmonar seja a terapêutica padrão, muito segura e eficaz para recém-nascidos com SDRA, o tratamento com tensioactivo recombinante baseado em SP-C não demonstrou uma melhor sobrevivência em grandes ensaios controlados e aleatorizados em adultos (18). O importante é que o uso de tensioactivos naturais parece ser vantajoso em comparação com os tensioactivos sintéticos (16, 17), com melhoria significativa na oxigenação sanguínea e menor tempo de ventilação nos lactentes (16)., A síndrome de aspiração de mecónio assemelha-se à pneumonia COVID-19 com produção reduzida de surfactantes e destruição de células alveolares do tipo II (21). A administração precoce de surfactante pulmonar natural diminuiu o tempo de tratamento e ventilação do ECMO (21). Isto sugere que a administração precoce de surfactante pulmonar natural poderia, de facto, melhorar a função pulmonar também em doentes adultos com SDRA grave, enquanto a causa da morte pode não ser apenas o pulmão colapsado, mas sim uma falência multi-orgânica., Além disso, diferentes fatores de risco para o desenvolvimento de ARDS e diferentes fenótipos implicam possíveis efeitos variáveis devido a medidas terapêuticas. Assim, são concebíveis efeitos benéficos da terapêutica surfactante em doentes com SDRA associados ao COVID-19, especialmente quando aplicados no início da estratégia de tratamento contra a insuficiência pulmonar.,devido à robusta eficácia anti-inflamatória e protectora pulmonar e à necessidade urgente de terapia de suporte pulmonar, propomos o tratamento adjuvante de doentes com pneumonia COVID-19 com ICUs com tensioactivos pulmonares naturais, para além do actual padrão de tratamento intensivo de ARDS. Os dados actuais sugerem que isto aumentaria a oxigenação sanguínea, reduziria o edema pulmonar e melhoraria a reacção inflamatória excessiva encontrada nas autópsias pulmonares de COVID-19 doentes (22)., Windtree therapeutics™ anunciou seu plano para testar KL4, um surfactante sintético, em pacientes graves infectados com COVID-19 (https://www.windtreetx.com/). Na Alemanha, Lyomark Pharma GmbH está planejando para testar a sua natural multicomponente surfactante pulmonar bovactant em adultos COVID-19 pacientes com pneumonia bem (www.lyomark.com).
Comercialmente disponíveis surfactante pulmonar é relativamente barato para UTI normas, facilmente disponível e não tem efeitos colaterais em crianças e adultos., Deve ser tomado cuidado em pacientes com alergia conhecida contra bovino ou de suíno produtos, como pulmão surfactantes são principalmente colhidos em bovinos (bovactant, Alveofact®) ou suínos (poractant alfa, Curosurf®) pulmões por lavagem ou tecido picagem seguido pela extração da fração lipídica.a administração de
é simples adicionando o liofilizado reconstituído ao tubo traqueal do doente ventilado que fornece o medicamento directamente para o espaço alveolar. No que diz respeito ao bovactant, um nebulizador foi recentemente aprovado para uso clínico nos EUA pela FDA., Ao cobrir a superfície exterior de alvéolos, o surfactante pulmonar actua directamente nas células inflamatórias, reduzindo a produção de citoquinas e a destruição dos tecidos. Deste modo, restaura a barreira pulmonar e assim evita o colapso pulmonar (Figura 2). Consequentemente, irá reduzir a duração da terapia de ventilação, facilitar a respiração e, assim, contribuir para a recuperação dos doentes.
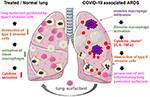
Figura 2. Mecanismo hipotético de surfactante pulmonar aplicado externamente para protecção pulmonar em ARDS graves associadas ao COVID-19., COVID-19 associados a SDRA é caracterizado por uma enorme infiltração de macrófagos, tecido alveolar de ativação macrofágica e uma potencialização da produção de citocina no pulmão (citocina “tempestade”), o que leva à destruição do surfactante produção tipo II alveolares, células, o que piora a situação, a perda de anti-inflamatórios, anti-fibrótica surfactante pulmonar. O surfactante exógeno pode reduzir a inflamação e, assim, restaurar a sobrevivência pulmonar. Criado usando arte médica inteligente servier sob https://creativecommons.org/licenses/by/3.0/.,
contribuições do autor
todos os autores contribuíram para a concepção, escrita e conceptualização do manuscrito. Um E KM editaram e desenharam as figuras.
conflito de interesses
os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
agradecimentos
gostaríamos de agradecer Desiree Schumann (Universidade de Basileia) pelo seu apoio perspicaz na escrita deste manuscrito., Os autores são apoiados pela Fundação de pesquisa alemã (DFG) e JDRF. Queremos pedir desculpas por não citar muitas publicações importantes devido a limitações de espaço.
9. Bernhard W. Lung surfactant: function and composition in the context of development and respiratory physiology. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Resumo | CrossRef Texto Completo | Google Scholar
10. Wright JR., The “wisdom” of lung surfactant: balancing host defense and surface tension-reducing functions. Am J Physiol Lung Cell Mol Physiol. (2006) 291:L847–50. doi: 10.1152 / ajplung.00261.2006
PubMed Resumo | CrossRef Texto Completo | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-uma nova proteína surfactante da superfície ocular e seu papel na cicatrização da ferida da córnea e tensão superficial do filme rasgado. SIC Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. J Perinatol. (2006) 26 (Suppl. 1): S51–6; discussão S63-4. doi: 10.1038/sj.jp.7211474
PubMed Resumo | CrossRef Texto Completo | Google Scholar
16. Já fui JV, Zimmermann LJ. O que há de novo no surfactante? A clinical view on recent developments in neonatology and paediatrics. Europ J Pediatria. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Resumo | CrossRef Texto Completo | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumactante e poractante alfa para o tratamento da síndrome de dificuldade respiratória em recém-nascidos com 25-29 semanas de gestação: um ensaio aleatorizado. Lanceta. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar