Ainutlaatuinen Kemia Kevyin Elementtejä
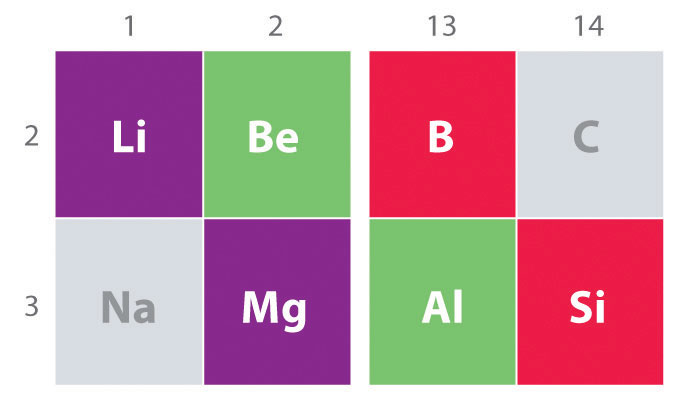
kemia toinen-aikana osa kunkin ryhmän (n = 2: Li, Be, B, C, N, O ja F) eroaa monessa tärkeässä suhteessa, että raskaampi jäseniä, tai yhdisteiden ryhmä. Näin ollen elementtejä kolmannen kauden (n = 3: Na, Mg, Al, Si, P, S ja Cl -) ovat yleensä enemmän edustava ryhmä, johon he kuuluvat., Poikkeava kemia toinen-ajan elementtejä tuloksia kolme tärkeitä ominaisuuksia: pieni säteet, energeettisesti ole käytettävissä d-orbitaalit, ja taipumus muodostaa pi (π) joukkovelkakirjojen muiden atomien.
toisin kuin kemia toinen-ajan elementit, kemia kolmas-ajan elementtejä on enemmän edustaja kemia kunkin ryhmän.
Koska niiden pieni säteet, toinen-ajan elementtejä electron on yhtäläisyyksiä, jotka ovat vähemmän negatiivisia kuin olisi ennustaa yleensä määräajoin suuntauksia., Kun tällaiseen pieneen atomiin lisätään elektroni, lisääntyneet elektroni-elektronien repulsiot pyrkivät horjuttamaan anionia. Lisäksi näiden alkuaineiden pienet koot estävät niitä muodostamasta yhdisteitä, joissa niillä on enemmän kuin neljä lähintä naapuria. Näin BF3 muodostaa vain neljä-koordinaatti, tetraedri BF4− ion, kun taas samoissa olosuhteissa AlF3 muodostaa kuusi-koordinaatti, octahedral AlF63− ion. Koska pienten atomien koko, yksinkertainen binary ionisia yhdisteitä toinen-ajan elementtejä myös enemmän kovalenttinen luonne kuin vastaava yhdisteitä muodostuu niiden raskaammat yhdisteet., Hyvin pieni kationeja, jotka on johdettu toinen-ajan elementtejä on korkea lataus-to-säde-suhde ja voi siksi polarisoi täynnä valence kuori on anioni. Sellaisenaan, liimaus tällaisia yhdisteitä on merkittävä kovalenttinen komponentti, jolloin yhdisteiden ominaisuuksia, jotka voivat erota toisistaan huomattavasti niiden odotetaan yksinkertainen ionisia yhdisteitä. Esimerkkinä, LiCl, joka on osittain kovalenttinen luonne, on paljon enemmän liukoista kuin NaCl liuottimia, joilla on suhteellisen alhainen dielektrisyysvakio, kuten etanolia (ε = 25.3 vs. 80.1 H2O).,
Koska d-orbitaalit eivät ole koskaan miehitetty principal quantum numeroita on vähemmän kuin 3, valence elektronit toisen kauden osat vievät 2s-ja 2p-orbitaalit vain. 3D-orbitaalien energia ylittää huomattavasti 2s-ja 2p-orbitaalien energian, joten niiden käyttäminen sidosaineena on energeettisesti estävää. Näin ollen elektronikonfiguraatioita, joissa on enemmän kuin neljä elektroniparia Keskisen, toisen jakson alkuaineen ympärillä, ei yksinkertaisesti havaita. Saatat muistaa, että D-orbitaalien rooli sitoutumisessa pääryhmäyhdisteisiin, joiden koordinaatioluvut ovat vähintään 5, on edelleen jokseenkin kiistanalainen., SF6: n kaltaisten molekyylien sidoksen teoreettiset kuvaukset on itse asiassa julkaistu mainitsematta d-orbitaalien osallistumista rikkiin. Väitteet, jotka perustuvat d-radan käytettävyys ja pieni koko keski-atom, kuitenkin ennustaa, että koordinoinnin määrä on suurempi kuin 4 epätavallinen elementtejä toisen kauden, joka on kanssa kokeellisia tuloksia.,
Yksi kaikkein dramaattisia eroja kevyin pääryhmän alkuaineita ja niiden raskaampien yhdisteiden on taipumus toinen-ajan elementit muodostavat lajit, jotka sisältävät useita joukkovelkakirjoja. Esimerkiksi n on hieman P: n yläpuolella ryhmässä 15: N2 sisältää N≡N sidoksen, mutta jokainen tetraedrisen P4: n fosforiatomi muodostaa kolme P–P-sidosta. Tämä käyttäytymisero kuvastaa sitä, että samassa jaksollisen järjestelmän ryhmässä π-sidoksen ja sigma (σ) – sidoksen suhteelliset energiat eroavat toisistaan. Esimerkiksi C=C-sidos on noin 80 prosenttia vahvempi kuin C–C-sidos., Sen sijaan, Si=Si bond, vähemmän p-silmäkuopan päällekkäin välillä valence-orbitaalit sidottu atomien koska suurempien atomien koko, on vain noin 40% vahvempi kuin Si–Si bond. Näin ollen yhdisteitä, jotka sisältävät sekä useita ja yhden C-C-sidokset ovat yhteisiä hiiltä, mutta yhdisteet, jotka sisältävät ainoastaan sigma Si–Si joukkovelkakirjalainat ovat enemmän energeettisesti suotuisa pii ja muut kolmas-ajan elementtejä.,
Toinen tärkeä trendi huomata, main group chemistry on kemiallinen samankaltaisuus kevyin elementti yksi ryhmä ja elementti välittömästi alapuolella ja oikealla puolella se seuraava ryhmä, ilmiö tunnetaan lävistäjä vaikutus (Luku \(\PageIndex{2}\)) On olemassa, esimerkiksi, merkittäviä yhtäläisyyksiä kemia Li ja Mg, ja Al -, ja B-ja Si. Molemmat BeCl2 ja AlCl3 on huomattava kovalenttinen luonne, joten ne ovat jonkin verran liukoinen ei-polaarisia orgaanisia liuottimia., Sen sijaan, vaikka Mg ja ovat samassa ryhmässä, MgCl2 käyttäytyy kuten tyypillinen ionic halide koska alempi elektronegatiivisuus ja suurempi koko magnesiumia.