Introducción
el virus de la Corona SARS-CoV-2 ya se ha extendido por todo el mundo y actualmente, sin vacuna disponible, es imparable. Actualmente, la COVID-19 afecta a más de 3.000.000 de pacientes confirmados en todo el mundo. Los medicamentos de primera línea son antivirales y se están llevando a cabo múltiples ensayos clínicos urgentes., Sin embargo, un ensayo clínico reciente que probó la combinación de inhibidores de la proteasa del VIH lopinavir y ritonavir no mostró actividad antiviral significativa contra el SARS-CoV-2 en pacientes con enfermedad grave (1). Mientras no tengamos terapias antivirales específicas contra el SARS-CoV-2, necesitamos proporcionar terapias sintomáticas de apoyo para prevenir la insuficiencia pulmonar, la causa más común de mortalidad por COVID-19.,
las células alveolares de tipo II están dañadas por la infección Viral del SARS-COV-2
y la destrucción de las células alveolares resultante atrae a las células inmunitarias con una exudativa alveolar excesiva y una reacción inflamatoria intersticial. Una tormenta de producción de citoquinas y quimioquinas resulta en la destrucción del tejido pulmonar y, en última instancia, en el síndrome de distrés respiratorio agudo severo (SDRA). Tanto el SARS-CoV-2 como el SARS-CoV entran en las células a través del receptor 2 de la enzima convertidora de angiotensina (ACE2)., La ACE2 está altamente expresada en la superficie apical de los epitelios de las vías respiratorias, endotelios vasculares, tejidos renales y cardiovasculares, así como en otras células (2). A medida que entran a través del tracto respiratorio, el SARS-CoV y el SARS-CoV-2 pueden destruir específicamente las células, que expresan predominantemente el receptor ACE2 en sus superficies, es decir, las células alveolares tipo II (2, 3).
como células progenitoras del epitelio alveolar, las células alveolares tipo II son las «defensoras del alveolo» (4)., Mantienen la homeostasis alveolar, especialmente después del daño pulmonar microbiano, donde controlan la respuesta inflamatoria.
a través de su producción del surfactante pulmonar Protector, las células alveolares tipo II reducen la tensión superficial pulmonar y facilitan así la respiración y el intercambio gaseoso, y además, son centrales para los procesos de reparación después de un trauma (5) (Figura 1). El daño a las células alveolares tipo II reduce drásticamente la producción de surfactante pulmonar y la secreción al espacio alveolar., Esto es seguido por la atelectasia debido a la disfunción del surfactante pulmonar que reduce aún más el cumplimiento pulmonar (6). La interfase aire-líquido se perturba en los pacientes infectados por el SARS-CoV-2, lo que provoca daño pulmonar. La ACE2 en sí protege de las lesiones pulmonares a través de mecanismos antiinflamatorios y antifibróticos. Por lo tanto, el uso de la enzima convertidora de angiotensina recombinante (ECA) no solo bloquearía los sitios de unión de los receptores del virus, sino que también proporcionaría protección pulmonar. En el escenario en el que el SARS-CoV-2 se une a la ACE2, la Unión protectora de la ECA se reduce gravemente., La destrucción de las células alveolares es seguida por una reducción de la oxigenación sanguínea, fibrosis pulmonar, edema, deterioro de la regeneración y, en última instancia, conduce a insuficiencia respiratoria (7).
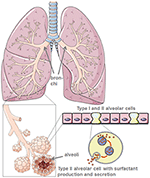
la Figura 1. Modelo de morfología pulmonar y alveolar. El surfactante pulmonar es producido por las células alveolares de tipo II. Creado usando smart servier medical art bajo https://creativecommons.org/licenses/by/3.0/.,
surfactante pulmonar como tratamiento antiinflamatorio protector del SDRA
la insuficiencia respiratoria también se conoce desde un origen completamente diferente, a saber, en bebés prematuros con una producción reducida de surfactante pulmonar en comparación con los niños nacidos a término. Sin suficiente surfactante pulmonar, el colapso de los alvéolos durante la exhalación resulta en una pobre oxigenación de la sangre.
Las superficies pulmonares representan la interfase aire-líquido y están en movimiento constante durante la entrada y la exhalación. Este último confiere el riesgo de colapso tisular debido a la tensión superficial del fluido., El pulmón supera este peligro cubriendo su superficie con surfactante pulmonar. El surfactante pulmonar se produce en células especializadas que se encuentran en las ramas terminales de los pulmones, células alveolares tipo II, que comienzan a producir surfactante pulmonar inmediatamente después del nacimiento (8).
el surfactante pulmonar es una mezcla de fosfolípidos y cuatro proteínas surfactantes (SP), a saber, las hidrofílicas SP-A y SP-D, también llamadas colectinas, y las lipofílicas SP-B y SP-C (9). El surfactante pulmonar reduce la tensión superficial y, por lo tanto, evita el colapso alveolar durante la exhalación., Todos los SP contribuyen a las respuestas inmunitarias innatas del pulmón, mientras que los SP-B y SP-C también influyen en la consistencia del surfactante rico en fosfolípidos (10). Recientemente, se describieron nuevas proteínas asociadas a surfactantes (SFTA) con propiedades similares en comparación con el SP «clásico» (11-13). SFTA2 es hidrofílico y muestra propiedades similares en comparación con SP – A y SP-D (13). SFTA3 mejora la fagocitosis de líneas celulares de macrófagos (14) y es una proteína anfifílica (12)., Por lo tanto, es probable que esté presente en las extracciones lipofílicas de pulmones animales disponibles comercialmente y podría aumentar la actividad fagocitótica de los macrófagos contra el CoV-2.
en bebés prematuros, la producción de surfactante pulmonar es insuficiente, con una pobre oxigenación sanguínea y una alta tensión superficial alveolar que conduce a un aumento de la reacción inflamatoria.
a partir de finales de los años setenta, se estableció con éxito un surfactante pulmonar exógeno bovino o porcino derivado del lavado bronquial como terapia para el SDRA en niños prematuros., El tratamiento con surfactantes pulmonares conduce a una mayor oxigenación y a una mayor supervivencia (15-17). Cabe destacar que el tratamiento con surfactante pulmonar natural tuvo un mejor resultado con respecto a la supervivencia infantil en comparación con el surfactante pulmonar sintético (17). Los surfactantes pulmonares naturales son una mezcla de lípidos (90%) y proteínas surfactantes (10%) que regulan la actividad de los macrófagos alveolares y reducen la inflamación. La fracción surfactante pulmonar lipofílica tiene propiedades antiinflamatorias cuando se aplica intratraquealmente al pulmón (18) así como tópicamente sobre la piel (19)., En la piel, el surfactante pulmonar reduce la expresión de genes proinflamatorios Y Pro fibróticos en heridas in vivo. En varios modelos murinos y humanos in vitro e in vivo de inflamación de heridas, el surfactante pulmonar redujo el TNF-α, el TACE y la IL-6 (19), que están muy elevados en pacientes con COVID-19 gravemente afectados.
los hallazgos recientes muestran que el SARS-CoV-2 induce la destrucción de las células alveolares tipo II en la neumonía asociada a la COVID-19 (2). Exactamente esas células producen surfactante pulmonar y previenen el colapso pulmonar., Además, la linfocitopenia con liberación masiva de citocinas es otro factor que conduce a la insuficiencia pulmonar y la muerte en casos graves de pacientes con COVID-19. Por lo tanto, se han sugerido dianas antiinflamatorias como anti-TNF y anti-IL-6 para controlar mejor la infección severa por COVID-19 (20).,
discusión: el uso de surfactante pulmonar para la restauración de la barrera pulmonar en pacientes con neumonía por COVID-19
aunque el tratamiento con surfactante pulmonar es el tratamiento estándar, muy seguro y eficaz para neonatos con SDRA, el tratamiento con surfactante recombinante basado en SP-C no mostró una mejora de la supervivencia en los principales ensayos controlados aleatorizados en adultos (18). Es importante destacar que el uso de surfactantes naturales parece ser ventajoso en comparación con los surfactantes sintéticos (16, 17) con una mejora significativa en la oxigenación de la sangre y un menor tiempo de ventilación en los bebés (16)., El síndrome de aspiración de meconio se asemeja a la neumonía por COVID-19 con una producción reducida de surfactante y destrucción de células alveolares tipo II (21). La administración temprana de surfactante pulmonar natural disminuyó la terapia ECMO y el tiempo de ventilación (21). Esto sugiere que la administración temprana de surfactante pulmonar natural podría mejorar la función pulmonar también en pacientes adultos con SDRA grave, mientras que la causa de muerte puede no ser el colapso pulmonar solo, sino más bien una falla multiorgánica., Además, diferentes factores de riesgo para el desarrollo de SDRA y diferentes fenotipos implican posibles efectos variables debido a las medidas terapéuticas. Por lo tanto, se pueden concebir efectos beneficiosos de la terapia surfactante en pacientes con SDRA asociados a la COVID-19, especialmente cuando se aplica al principio de la estrategia de tratamiento contra la insuficiencia pulmonar.,
debido a la sólida eficacia antiinflamatoria y protectora de los pulmones y la urgente necesidad actual de terapia de apoyo pulmonar, proponemos el tratamiento adyuvante de pacientes con neumonía por COVID-19 en UCI con surfactantes pulmonares naturales, además del estándar actual de tratamiento de cuidados intensivos ARDS. La evidencia actual sugiere que esto aumentaría la oxigenación sanguínea, reduciría el edema pulmonar y mejoraría la reacción inflamatoria excesiva encontrada en las autopsias pulmonares de pacientes con COVID-19 (22)., Windtree therapeutics™ anunció su plan para probar KL4, un surfactante sintético, en pacientes infectados por COVID-19 graves (https://www.windtreetx.com/). En Alemania, Lyomark Pharma GmbH también planea probar su surfactante pulmonar multicomponente natural bovactant en pacientes adultos con COVID-19 con neumonía (www.lyomark.com).
el surfactante pulmonar comercialmente disponible es relativamente barato para los estándares de la UCI, fácilmente disponible y no tiene efectos secundarios conocidos en niños y adultos., Se debe tener precaución en pacientes con alergias conocidas a productos bovinos o porcinos, ya que los surfactantes pulmonares se recolectan principalmente de pulmones bovinos (bovactant, Alveofact®) o porcinos (poractant alfa, Curosurf®) mediante lavado o picadura de tejido seguida de extracción de la fracción lipídica.
La administración es simple agregando el liofilizado reconstituido en el tubo traqueal del paciente ventilado que entrega la medicina directamente al espacio alveolar. Con respecto a bovactant, un nebulizador fue aprobado recientemente para uso clínico en los EE.UU. por la FDA., Al cubrir la superficie externa de los alvéolos, el surfactante pulmonar actúa directamente sobre las células inflamatorias reduciendo la producción de citoquinas y la destrucción de tejidos. De este modo, restaura la barrera pulmonar y así previene el colapso pulmonar (Figura 2). En consecuencia, reducirá la duración de la terapia de ventilación, facilitará la respiración y, por lo tanto, contribuirá a la recuperación de los pacientes.
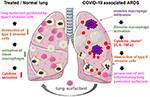
la Figura 2. Mecanismo hipotético del surfactante pulmonar aplicado externamente para la protección pulmonar en el SDRA asociado a la COVID-19 grave., La SDRA asociada a la COVID-19 se caracteriza por infiltración masiva de macrófagos, activación de macrófagos alveolares tisulares y una potenciación de la producción de citoquinas en el pulmón (cytokine «storm»), lo que conduce a la destrucción de las células alveolares productoras de surfactante tipo II, lo que empeora la situación a través de la pérdida de surfactante pulmonar antiinflamatorio y antifibrótico. El surfactante exógeno puede reducir la inflamación y, por lo tanto, restaurar la supervivencia pulmonar. Creado usando smart servier medical art bajo https://creativecommons.org/licenses/by/3.0/.,
Aportes del Autor
Todos los autores que contribuyeron al diseño, la escritura y la conceptualización del manuscrito. UM Y KM editaron y diseñaron las figuras.
conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
agradecimientos
nos gustaría agradecer a Desiree Schumann (Universidad de Basilea) por su perspicaz apoyo en la redacción de este manuscrito., Los autores cuentan con el apoyo de la fundación alemana de investigación (DFG) y la JDRF. Queremos disculparnos por no citar muchas publicaciones importantes debido a limitaciones de espacio.
9. Bernhard W. Lung surfactant: function and composition in the context of development and respiratory physiology. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract | CrossRef Texto Completo | Google Scholar
10. Wright JR., The» wisdom » of lung surfactant: balancing host defense and surface tension-reducing functions (en inglés). Am J Physiol Lung Cell Mol Physiol. (2006) 291:L847–50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstract | CrossRef Texto Completo | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3 – una nueva proteína surfactante de la superficie ocular y su papel en la curación de heridas corneales y la tensión superficial de la película lagrimal. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Surfactant therapy in pretérmino infants with respiratory distress syndrome and in near-term or term newnors with acute RDS. J Perinatol. (2006) 26 (Suppl. 1): S51–6; discusión S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstract | CrossRef Texto Completo | Google Scholar
16. Estado JV, Zimmermann LJ. ¿Qué hay de nuevo en surfactante? A clinical view on recent developments in neonatology and paediatrics. Europ J Pediatrics. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Texto Completo | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumactant y poractant alfa para el tratamiento del síndrome de distrés respiratorio en neonatos nacidos a las 25-29 semanas de gestación: un ensayo aleatorizado. Lanceta. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar