química única de los elementos más ligeros
la química del elemento del segundo período de cada grupo (N = 2: Li, Be, B, C, N, O, and F) difiere en muchos aspectos importantes de la de los miembros más pesados, o congéneres, del grupo. En consecuencia, los elementos del tercer período (n = 3: Na, Mg, Al, Si, P, S y Cl) son generalmente más representativos del grupo al que pertenecen., La química anómala de los elementos del segundo período resulta de tres características importantes: radios pequeños, orbitales d energéticamente no disponibles, y una tendencia a formar enlaces pi (π) con otros átomos.
en contraste con la química de los elementos del segundo período, La química de los elementos del tercer período es más representativa de la química del grupo respectivo.
debido a sus pequeños radios, los elementos del segundo período tienen afinidades electrónicas que son menos negativas de lo que se podría predecir a partir de las tendencias periódicas generales., Cuando se agrega un electrón a un átomo tan pequeño, el aumento de las repulsiones electrón–electrón tienden a desestabilizar el anión. Además, los pequeños tamaños de estos elementos les impiden formar compuestos en los que tienen más de cuatro vecinos más cercanos. Así BF3 forma solo el cuatro− coordenada, tetraédrico BF4-ion, mientras que bajo las mismas condiciones AlF3 forma el seis-coordenada, octaédrico AlF63-ion. Debido al tamaño atómico más pequeño, los compuestos iónicos binarios simples de elementos del segundo período También tienen más carácter covalente que los compuestos correspondientes formados a partir de sus congéneres más pesados., Los cationes muy pequeños derivados de elementos del segundo período tienen una alta relación carga-radio y por lo tanto pueden polarizar la capa de Valencia llena de un anión. Como tal, la Unión en tales compuestos tiene un componente covalente significativo, dando a los compuestos propiedades que pueden diferir significativamente de las esperadas para compuestos iónicos simples. Como ejemplo, el LiCl, que es parcialmente covalente en carácter, es mucho más soluble que el NaCl en disolventes con una constante dieléctrica relativamente baja, como el etanol (ε = 25.3 versus 80.1 para H2O).,
debido a que los orbitales d nunca están ocupados para números cuánticos principales menores que 3, los electrones de Valencia de los elementos del segundo período ocupan orbitales 2s y 2P solamente. La energía de los orbitales 3d excede con creces la energía de los orbitales 2s y 2p, por lo que usarlos en la unión es energéticamente prohibitivo. En consecuencia, las configuraciones electrónicas con más de cuatro pares de electrones alrededor de un elemento central del segundo período Simplemente no se observan. Usted puede recordar que el papel de los orbitales d en la Unión en los compuestos del grupo principal con números de coordinación de 5 o más sigue siendo algo controvertido., De hecho, se han publicado descripciones teóricas del enlace en moléculas como el SF6 sin mencionar la participación de orbitales d en azufre. Los argumentos basados en la disponibilidad del orbital d y en el pequeño tamaño del átomo central, sin embargo, predicen que los números de coordinación superiores a 4 son inusuales para los elementos del segundo período, Lo que está de acuerdo con los resultados experimentales.,
una de las diferencias más dramáticas entre los elementos del grupo principal más ligeros y sus congéneres más pesados es la tendencia de los elementos del segundo período a formar especies que contienen enlaces múltiples. Por ejemplo, N está justo por encima de P en el grupo 15: N2 contiene un enlace N N N, pero cada átomo de fósforo en P4 tetraédrico forma tres enlaces P-P. Esta diferencia en el comportamiento refleja el hecho de que dentro del mismo grupo de la Tabla periódica, las energías relativas del enlace π y el enlace sigma (σ) difieren. Un enlace C=C, Por ejemplo, es aproximadamente un 80% más fuerte que un enlace C–C., En contraste, un enlace Si = Si, con menos superposición p-orbital entre los orbitales de Valencia de los átomos enlazados debido al mayor tamaño atómico, es solo alrededor del 40% más fuerte que un enlace Si–Si. En consecuencia, los compuestos que contienen múltiples y simples enlaces C A C son comunes para el carbono, pero los compuestos que contienen solo enlaces sigma Si–Si son más energéticamente favorables para el silicio y los otros elementos del tercer período.,
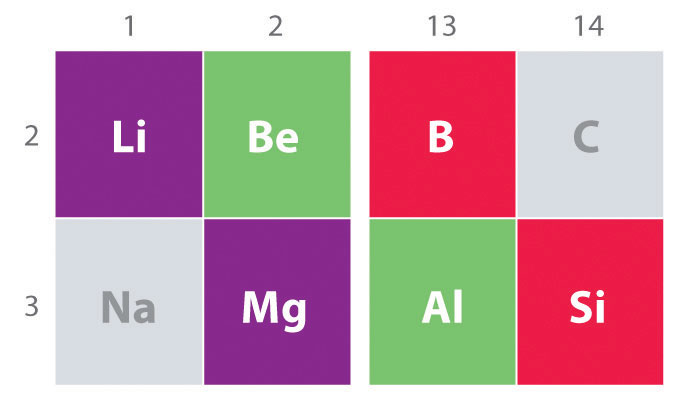
otra tendencia importante a tener en cuenta en la química del grupo principal es la similitud química entre el elemento más ligero de un grupo y el elemento inmediatamente inferior y a la derecha de él en el siguiente grupo, un fenómeno conocido como el efecto diagonal (figura \(\PageIndex{2}\)) hay, por ejemplo, similitudes significativas entre la química de Li y Mg, Be y Al, y B y Si. Tanto BeCl2 como AlCl3 tienen un carácter covalente sustancial, por lo que son algo solubles en disolventes orgánicos no polares., En contraste, aunque Mg y Be están en el mismo grupo, MgCl2 se comporta como un haluro iónico típico debido a la menor electronegatividad y el mayor tamaño del magnesio.