Einführung
Das Coronavirus SARS-CoV-2 hat sich bereits auf der ganzen Welt verbreitet und ist derzeit ohne Impfstoff nicht mehr aufzuhalten. Laut heute betrifft COVID-19 weltweit mehr als 3,000,000 bestätigte Patienten. First Line Medikamente sind antivirale Medikamente und mehrere dringende klinische Studien sind im Gange., Eine kürzlich durchgeführte klinische Studie, in der die HIV-Protease-Inhibitor-Kombination Lopinavir und Ritonavir getestet wurde, zeigte jedoch keine signifikante antivirale Aktivität gegen SARS-CoV-2 bei Patienten mit schwerer Erkrankung (1). Solange wir keine spezifischen antiviralen Therapien gegen SARS-CoV-2 haben, müssen wir unterstützende symptomatische Therapien anbieten, um Lungenversagen, die häufigste Ursache für COVID-19-Mortalität, zu verhindern.,
Alveolarzellen vom Typ II werden durch SARS-COV-2 geschädigt
Virusinfektion und daraus resultierende Alveolarzellzerstörung ziehen Immunzellen mit einer übermäßigen alveolären exsudativen und interstitiellen Entzündungsreaktion an. Ein Sturm der Zytokin – und Chemokinproduktion führt zu einer Zerstörung des Lungengewebes und letztendlich zu einem schweren akuten Atemnotsyndrom (ARDS). SARS-CoV-2 sowie SARS-CoV gelangen über den Angiotensin-Converting-Enzym-Rezeptor 2 (ACE2) in die Zellen., ACE2 wird stark auf der apikalen Oberfläche der Atemwegsepithelie, der vaskulären Endothelie, des Nieren-und Herz-Kreislauf-Gewebes sowie verschiedener anderer Zellen exprimiert (2). Wenn sie durch die Atemwege gelangen, können SARS-CoV und SARS-CoV-2 spezifisch Zellen zerstören, die überwiegend den ACE2-Rezeptor auf ihren Oberflächen exprimieren, nämlich die Alveolarzellen vom Typ II (2, 3).
Als Vorläuferzellen für das Alveolarepithel sind Alveolarzellen vom Typ II der „Verteidiger der Alveole“ (4)., Sie behalten die alveoläre Homöostase bei, insbesondere nach mikrobiellen Lungenschäden, wo sie die Entzündungsreaktion kontrollieren.
Durch ihre Produktion des schützenden Lungenfaktors reduzieren Alveolarzellen vom Typ II die Lungenoberflächenspannung und erleichtern so die Atmung und den Gasaustausch und sind darüber hinaus zentral für Reparaturprozesse nach Traumata (5) (Abbildung 1). Eine Schädigung der Alveolarzellen vom Typ II reduziert die Produktion und Sekretion von Lungenfactant in den Alveolarraum drastisch., Es folgt eine Atelektase aufgrund einer Lungentensidfunktionsstörung, die die pulmonale Compliance weiter reduziert (6). Die Air-Liquid-Interphase ist bei SARS-CoV-2-infizierten Patienten gestört, was zu Lungenschäden führt. ACE2 selbst schützt vor Lungenverletzungen durch entzündungshemmende und antifibrotische Mechanismen. Somit würde die Verwendung von rekombinantem Angiotensin-Converting-Enzym (ACE) nicht nur Virusrezeptorbindungsstellen blockieren, sondern auch Lungenschutz bieten. In dem Szenario, in dem SARS-CoV-2 an ACE2 bindet, wird die schützende ACE-Bindung stark reduziert., Auf die Zerstörung der Alveolarzellen folgen eine verminderte Sauerstoffversorgung des Blutes, Lungenfibrose, Ödeme, eine gestörte Regeneration und letztendlich ein Atemversagen (7).
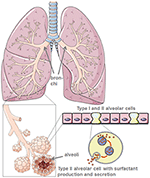
Abbildung 1. Modell der Lungen – und Alveolarmorphologie. Lungen-Tensid wird von Typ-II-Alveolarzellen produziert. Erstellt mit smart servier medical art unter https://creativecommons.org/licenses/by/3.0/.,
Lungentensid als schützende entzündungshemmende ARDS-Therapie
Atemversagen ist auch aus einem ganz anderen Ursprung bekannt, nämlich bei Frühgeborenen mit reduzierter Lungentensidproduktion im Vergleich zu frühgeborenen Kindern. Ohne ausreichendes Lungenaktiv kollabieren die Alveolen während des Ausatmens, was zu einer schlechten Sauerstoffversorgung des Blutes führt.
Lungenoberflächen zeigen die Luft-Flüssigkeits-Wechselphase und sind beim Ein – und Ausatmen in ständiger Bewegung. Letzteres birgt die Gefahr eines Gewebekollapses aufgrund von Flüssigkeitsoberflächenspannung., Die Lunge überwindet diese Gefahr, indem sie ihre Oberfläche mit Lungenaktiv bedeckt. Lungentensid wird in spezialisierten Zellen in den terminalen Lungenästen, Alveolarzellen des Typs II, produziert, die unmittelbar nach der Geburt mit der Produktion von Lungentensid beginnen (8).
Das Tensid ist eine Mischung aus Phospholipiden und vier Tensidproteinen (SP), nämlich den hydrophilen SP-A und SP-D, auch Collectine genannt, und den lipophilen SP-B und SP-C (9). Lungen-Tensid senkt die Oberflächenspannung und verhindert dadurch den Alveolarkollaps beim Ausatmen., Alle SP tragen zu den angeborenen Immunantworten der Lunge bei, während SP-B und SP-C auch die Konsistenz des phospholipidreichen Tensids beeinflussen (10). Kürzlich wurden neuartige Surfactant Associated Proteins (SFTA) mit ähnlichen Eigenschaften im Vergleich zum „klassischen“ SP (11-13) beschrieben. SFTA2 ist hydrophil und weist im Vergleich zu SP-A und SP-D ähnliche Eigenschaften auf (13). SFTA3 verstärkt die Phagozytose von Makrophagen-Zelllinien (14) und ist ein amphiphiles Protein (12)., Daher ist es wahrscheinlich in den handelsüblichen lipophilen Extraktionen tierischer Lungen vorhanden und könnte die phagozytotische Aktivität von Makrophagen gegen CoV-2 verstärken.
Bei Frühgeborenen ist die Tensidproduktion der Lunge bei schlechter Sauerstoffversorgung des Blutes und hoher Alveolaroberflächenspannung unzureichend, was zu einer erhöhten Entzündungsreaktion führt.
Ab Ende der siebziger Jahre wurde das aus der Bronchialspülung abgeleitete exogene Rinder-oder Schweinelungenaktid erfolgreich als Therapie für ARDS bei Frühgeborenen etabliert., Die Behandlung mit Lungentensidpräparaten führt zu einer verbesserten Sauerstoffversorgung und einem erhöhten Überleben (15-17). Bemerkenswert ist, dass die Behandlung mit natürlich vorkommendem Lungenfactant im Vergleich zu synthetischem Lungenfactant ein besseres Ergebnis hinsichtlich des Überlebens von Säuglingen hatte (17). Natürliche Lungentenside sind eine Mischung aus Lipiden (90%) und Tensidproteinen (10%), die die Aktivität von Alveolarmakrophagen regulieren und Entzündungen reduzieren. Die lipophile Lungentensidfraktion hat entzündungshemmende Eigenschaften bei intratrachealer Applikation auf die Lunge (18) sowie topisch auf die Haut (19)., In der Haut reduziert Lungen-Tensid die Expression von proinflammatorischen und profibrotischen Genen in Wunden in vivo. In verschiedenen In-vitro-und In-vivo-murinen und menschlichen Modellen von Wundentzündungen reduzierte das Lungenfactant TNF-α, TACE und IL-6 (19), die bei stark betroffenen COVID-19-Patienten stark erhöht sind.
Jüngste Ergebnisse zeigen, dass SARS-CoV-2 die Zerstörung von Alveolarzellen vom Typ II bei COVID-19-assoziierter Pneumonie induziert (2). Genau diese Zellen produzieren Lungenaktiv und verhindern Lungenkollaps., Darüber hinaus ist die Lymphozytopenie mit massiver Freisetzung von Zytokinen ein weiterer Faktor, der bei schweren Fällen von COVID-19-Patienten zu Lungenversagen und Tod führt. Daher wurden entzündungshemmende Ziele wie Anti-TNF und Anti-IL-6 vorgeschlagen, um eine schwere COVID-19-Infektion besser zu kontrollieren (20).,
Diskussion: Die Verwendung von Lungenfactant zur Wiederherstellung der pulmonalen Barriere bei Patienten mit COVID-19-Pneumonie
Obwohl die Lungenfactantherapie die Standardtherapie ist, zeigte eine sehr sichere und wirksame Therapie für Neugeborene mit ARDS bei der Behandlung mit rekombinantem SP-C-basiertem Tensid kein verbessertes Überleben in großen randomisierten kontrollierten Studien bei Erwachsenen (18). Wichtig ist, dass die Verwendung natürlicher Tenside im Vergleich zu synthetischen Tensiden (16, 17) vorteilhaft zu sein scheint, wobei die Sauerstoffversorgung des Blutes signifikant verbessert und die Belüftungszeit bei Säuglingen verkürzt wird (16)., Das Mekoniumaspirationssyndrom ähnelt einer COVID-19-Pneumonie mit reduzierter Tensidproduktion und Zerstörung von Alveolarzellen vom Typ II (21). Die frühe Verabreichung von natürlichem Lungenfactant verringerte die ECMO-Therapie und die Beatmungszeit (21). Dies deutet darauf hin, dass eine frühzeitige Verabreichung von natürlichem Lungenfactant in der Tat die Lungenfunktion auch bei erwachsenen Patienten mit schweren ARDS verbessern könnte, während die Todesursache möglicherweise nicht die kollabierte Lunge allein ist, sondern ein Multiorganversagen., Außerdem implizieren verschiedene Risikofaktoren für die Entwicklung von ARDS und verschiedene Phänotypen mögliche unterschiedliche Wirkungen aufgrund therapeutischer Maßnahmen. Daher sind vorteilhafte Wirkungen der Tensidtherapie bei COVID-19 assoziierten ARDS-Patienten denkbar, insbesondere wenn sie frühzeitig in der Behandlungsstrategie gegen Lungenversagen angewendet werden.,
Aufgrund der robusten entzündungshemmenden und lungenschützenden Wirkung und des heutigen dringenden Bedarfs an lungenstützender Therapie schlagen wir zusätzlich zum aktuellen Standard der ARDS-Intensivpflege die adjuvante Behandlung von Patienten mit COVID-19-Pneumonie auf Intensivstationen mit natürlichen Lungenaktiden vor. Aktuelle Beweise deuten darauf hin, dass dies die Sauerstoffversorgung des Blutes erhöhen, Lungenödeme reduzieren und die übermäßige Entzündungsreaktion bei Lungenautopsien von COVID-19-Patienten lindern würde (22)., Windtree therapeutics™ gab ihren Plan bekannt, KL4, ein synthetisches Tensid, bei schweren mit COVID-19 infizierten Patienten zu testen (https://www.windtreetx.com/). In Deutschland plant die Lyomark Pharma GmbH, ihr natürliches Mehrkomponenten-Lungenfactant Bovactant auch bei erwachsenen COVID-19-Patienten mit Lungenentzündung zu testen (www.lyomark.com).
Handelsübliches Lungenfactant ist relativ preiswert für ICU-Standards, leicht verfügbar und hat keine bekannten Nebenwirkungen bei Kindern und Erwachsenen., Bei Patienten mit bekannten Allergien gegen Rinder-oder Schweineprodukte ist Vorsicht geboten, da Lungenfactants meist aus Rinderlungen (Bovactant, Alveofact®) oder Schweinen (Poractant alfa, Curosurf®) durch Lavage oder Gewebemincing, gefolgt von Extraktion der Lipidfraktion, geerntet werden.
Die Verabreichung ist einfach, indem das rekonstituierte Lyophilisat in den Luftröhrchen des belüfteten Patienten gegeben wird, der das Arzneimittel direkt in den Alveolarraum abgibt. In Bezug auf Bovactant wurde kürzlich ein Vernebler von der FDA für den klinischen Einsatz in den USA zugelassen., Durch die Abdeckung der äußeren Oberfläche der Alveolen wirkt Lungenfactant direkt auf Entzündungszellen und reduziert die Zytokinproduktion und Gewebezerstörung. Dadurch stellt es die Lungenbarriere wieder her und verhindert so den Lungenkollaps (Abbildung 2). Folglich reduziert es die Dauer der Beatmungstherapie, erleichtert die Atmung und trägt so zur Genesung der Patienten bei.
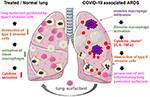
Abbildung 2. Hypothetischer Mechanismus des extern angewendeten Lungenfaktors für den Lungenschutz bei schweren COVID-19-assoziierten ARDS., Die mit COVID-19 assoziierte ARDS ist gekennzeichnet durch massive Makrophagen-Infiltration, Aktivierung der Alveolarmakrophagen im Gewebe und eine Potenzierung der Zytokinproduktion in der Lunge (Zytokin-„Sturm“), was zur Zerstörung von Tensid produzierenden Alveolarzellen vom Typ II führt, was die Situation durch den Verlust von entzündungshemmendem, antifibrotischem Lungenfactant verschlechtert. Exogenes Tensid kann Entzündungen reduzieren und somit das Lungenüberleben wiederherstellen. Erstellt mit smart servier medical art unter https://creativecommons.org/licenses/by/3.0/.,
Author Contributions
Alle Autoren haben zum Design, Schreiben und Konzeptualisieren des Manuskripts beigetragen. UM und KM bearbeiteten und gestalteten die Figuren.
Interessenkonflikt
Die Autoren erklären, dass die Forschung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken Desiree Schumann (Universität Basel) für ihre aufschlussreiche Unterstützung beim Schreiben dieses Manuskripts., Die Autoren werden von der Deutschen Forschungsgemeinschaft (DFG) und dem JDRF unterstützt. Wir möchten uns dafür entschuldigen, dass wir aufgrund von Platzbeschränkungen nicht viele wichtige Veröffentlichungen zitiert haben.
9. Bernhard W. Lungentensid: Funktion und Zusammensetzung im Kontext von Entwicklung und Atemphysiologie. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstract | CrossRef Volltext | Google Scholar
10. Wright JR., Die „Weisheit“ des Tensids: Ausgleich von Abwehr-und Oberflächenspannungs-reduzierenden Funktionen. Am J Physiol Lungenzelle Mol Physiol. (2006) 291:L847–50. doi: 10.1152/ajplung.00261.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-ein neuartiges Tensidprotein der Augenoberfläche und seine Rolle bei der Hornhautwundheilung und der Oberflächenspannung des Tränenfilms. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Tensidtherapie bei Frühgeborenen mit Atemnotsyndrom und bei kurzfristigen oder kurzfristigen Neugeborenen mit akuter RDS. J Perinatol. (2006) 26(Suppl. 1):S51–6; Diskussion S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Seit JV, Zimmermann LJ. Was ist neu in Tensid? Eine klinische Blick auf die jüngsten Entwicklungen in der Neonatologie und Pädiatrie. Europ J Pediatrics. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton, AC, et al. Pumactant und poractant alfa zur Behandlung des Atemnotsyndroms bei Neugeborenen, die in der Schwangerschaft von 25 bis 29 Wochen geboren wurden: randomisierte Studie. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar