E-und Z-Notation für Alkene
Inhaltsverzeichnis
- Wann verwenden wir cis-und Trans-Notation in Ringen?
- cis – und Trans-Isomerie In Alkenen
- Achten Sie auf mehrdeutige Namen, wenn geometrische Isomerie möglich ist!,
- cis – und trans– Isomerie in zyklischen Alkenen
- Wenn „cis“- und „trans'“ fehlschlägt: E-und Z-Notation
- E-und Z-Notation für Alkene
- Bindungen brechen: Die Methode der Punkte
- Schlussfolgerung: E-und Z-Notation für Alkene
- Notizen
- Quiz Yourself!
Dieser Beitrag wurde mit Matt Pierce von Organic Chemistry Solutions verfasst. Fragen Sie Matt hier nach der Planung einer Online-Nachhilfe.,
Kurzer Rückblick: cis – und Trans-Isomerie („Geometrische Isomerie“) in Ringen
Früher in unserer MOC-Serie über Cycloalkane haben wir gesehen, dass ein Schlüsselmerkmal kleiner Ringe darin besteht, dass sie nicht“ von innen nach außen “ gedreht werden können, ohne Bindungen zu brechen.
Eine der wichtigsten Konsequenz davon ist, dass es zur Existenz von Stereoisomeren führen kann-Moleküle, die die gleiche Molekülformel und die gleiche Konnektivität haben, aber eine andere Anordnung von Atomen im Raum haben.
Diese beiden Versionen von 1,2 Dichlorocyclopentan (unten) sind ein Beispiel., Sie haben die gleiche Konnektivität – beide sind 1,2-Dichlorcyclopentan -, haben aber unterschiedliche Anordnungen ihrer Atome im Weltraum. Die Chlorine befinden sich auf der gleichen Seite des Rings im linken Isomer (beide „Keile“, die aus der Seite kommen) und auf den gegenüberliegenden Seiten (eine verkeilt, eine gestrichelt) auf dem rechten Isomer.
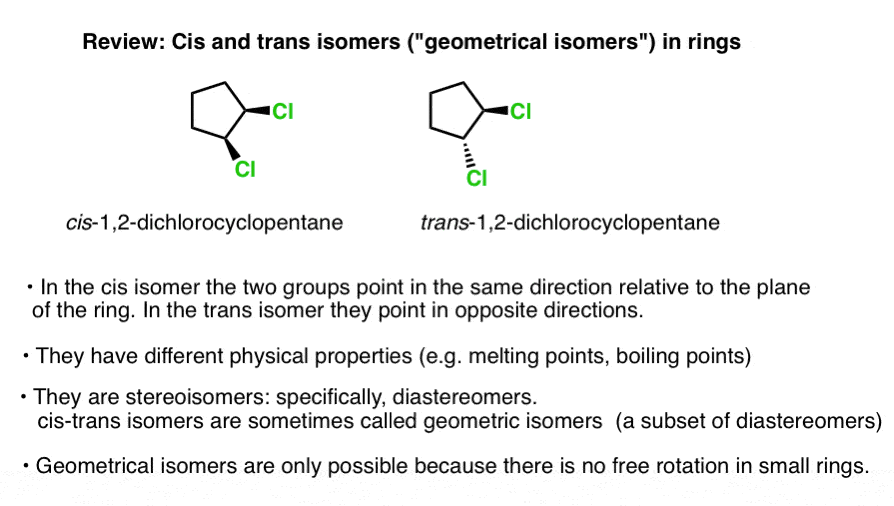
Diese beiden Moleküle können nicht durch Rotation der C-C-Bindung interkonvertiert werden, ohne den Ring zu brechen (verwenden Sie ein Modellkit und versuchen Sie es, wenn Sie möchten). Sie sind daher Isomere.,
Moleküle, die die gleiche Konnektivität, aber unterschiedliche Anordnung im Raum haben, werden als Stereoisomere bezeichnet.
Insbesondere ist die Beziehung zwischen den beiden oben genannten Molekülen die von Diastereomeren: Stereoisomere, die keine Spiegelbilder voneinander sind.
Diese beiden Moleküle haben unterschiedliche physikalische Eigenschaften-unterschiedliche Siedepunkte, Schmelzpunkte, Reaktivierungen, spektrale Eigenschaften und so weiter.
1. Wann verwenden Wir cis – Und Trans-Notation In Ringen?,
Wir verwenden die Begriffe cis – und trans–, um die relative Konfiguration von zwei Gruppen zueinander in Situationen zu bezeichnen, in denen die Rotation eingeschränkt ist.
In der Nomenklatur wird“ cis “ verwendet, um das Isomer zu unterscheiden, bei dem zwei identische Gruppen (z. B. die beiden Chlorine in 1,2-Dichlorcyclopentan) von der Ringebene in die gleiche Richtung zeigen, und trans, um das Isomer zu unterscheiden, wo sie in entgegengesetzte Richtungen zeigen.
Ein gebräuchlicher Name für diese sogenannten „cis-trans“ – Isomere ist „geometrische Isomere“.,
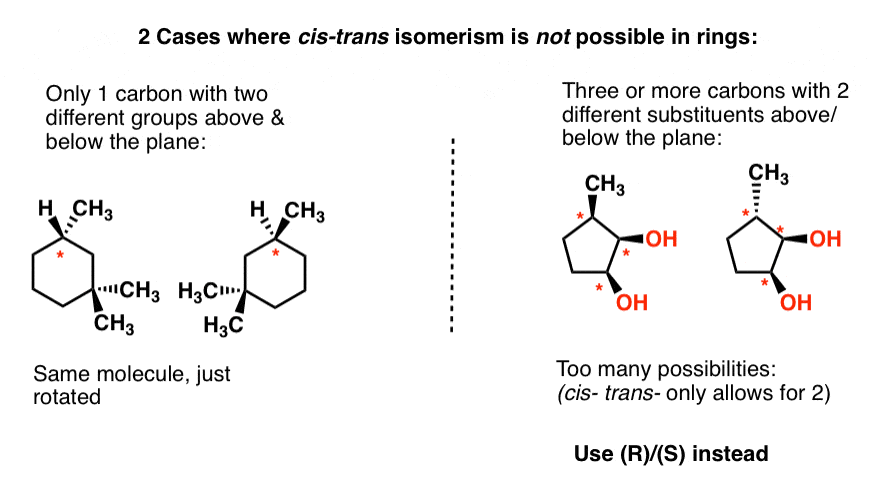
Damit cis – trans – Isomerie in Ringen existiert, benötigen wir zwei Bedingungen:
- zwei (und nur zwei) Kohlenstoffe, die jeweils nicht identische Substituenten über und unter dem Ring tragen
- Die beiden Kohlenstoffe haben mindestens einen dieser Substituenten gemeinsam
In 1,2-Dichlorcyclopentan haben wir festgestellt, dass C-1 und C-2 jeweils nicht identische Substituenten (H und Cl) oberhalb und unterhalb des Rings hatten
Hier ist ein weiteres Beispiel: cis – und trans-1-ethyl-2-methylcyclobutan., Beachten Sie, dass sie jeweils zwei Kohlenstoff haben, die jeweils nicht identische Substituenten über und unter dem Ring tragen (H und CH3; H und CH2CH3). Sie haben auch mindestens einen Substituenten gemeinsam (H). So können wir cis-1-ethyl-2-Methylcyclohexan als das Isomer bezeichnen, wo die beiden Hydrogene in die gleiche Richtung zeigen, und trans, wo sie in entgegengesetzte Richtungen zeigen.
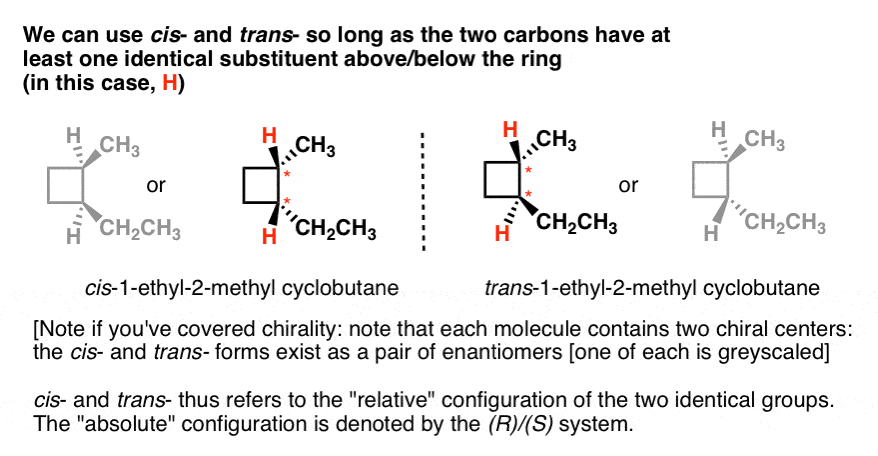
Wenn Sie die Chiralität behandelt haben, stellen Sie möglicherweise auch eine interessante Tatsache fest: Es gibt zwei Möglichkeiten, jedes der cis – und Trans– Isomere zu zeichnen, und sie können nicht überlagert werden., Das sind übrigens Enantiomere.
Damit cis – und trans-nicht angeben, welches Enantiomer (es kann auf beide angewendet werden). Es beschreibt nur die relative Konfiguration der beiden Gruppen (in diesem Fall H). Wenn wir ein bestimmtes Enantiomer angeben möchten, müssen wir das Cahn-Ingold-Prelog (CIP) – System zum Zuweisen von R-und S-Konfigurationen verwenden, das uns die „absolute“ Konfiguration zur Verfügung stellt. In diesem Fall ist cis– und trans – redundant.
Da cis– und trans-relativ sind, funktioniert es nicht, wenn die beiden Kohlenstoffe keinen gemeinsamen Substituenten haben. In diesem Fall müssen Sie auch (R)/(S) verwenden .,
Wir brauchen zu lange, um hier durch Ringe zu gehen, also lassen Sie uns einfach 2 Beispiele veranschaulichen, wo „cis“ und trans“ nicht in Ringen funktioniert und es dort belassen.
2. cis – und Trans-Isomerie (Geometrische Isomerie) In Alkenen
cis-trans-Isomerie ist auch für Alkene möglich. Wie bei kleinen Ringen ist auch die Drehung um Pi-Bindungen eingeschränkt: Aufgrund der“ Side-on “ – Überlappung von Pi-Bindungen kann man eine Pi-Bindung nicht drehen, ohne sie zu brechen., Dies steht im Gegensatz zu herkömmlichen Sigma-Bindungen (Einzelbindungen) in azyklischen Molekülen, bei denen eine freie Rotation möglich ist:-1,2-Dichlorethan (unten links).
Daher können wir Moleküle wie cis-1,2-Dichlorethen und trans-1,2-dichlorethen haben, die aufgrund ihrer unterschiedlichen physikalischen Eigenschaften voneinander getrennt werden können.
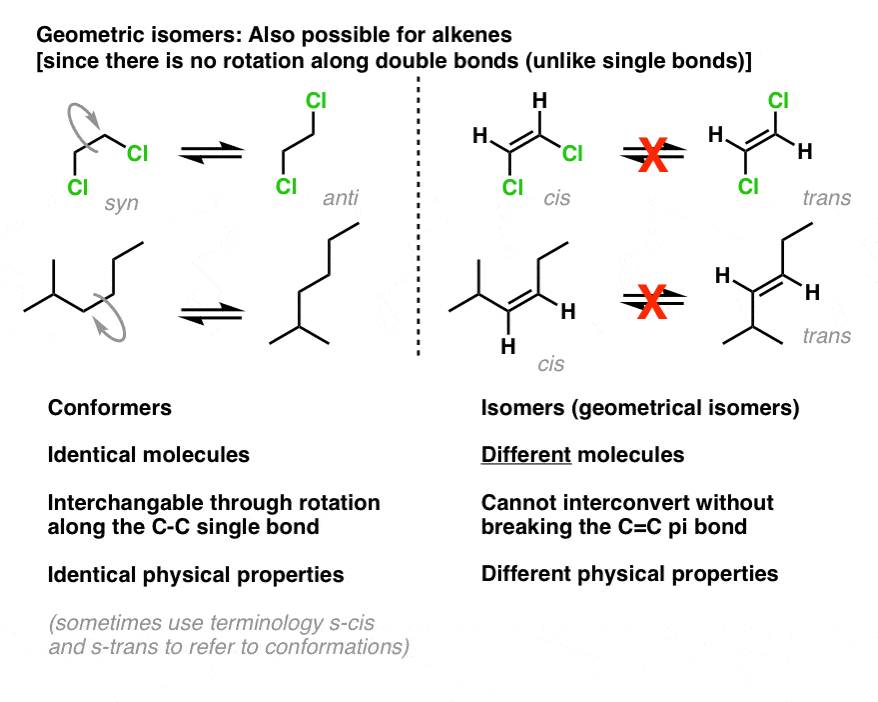
Wir können auch die cis–trans-Nomenklatur verwenden, um Isomere wie 2-Methyl-3-Hexen (oben rechts) zu unterscheiden., Im cis-Isomer befinden sich die beiden Hydrogene auf der gleichen Seite der pi-Bindung, und im Trans-Isomer befinden sich die beiden Hydrogene auf der gegenüberliegenden Seite der Bindung.
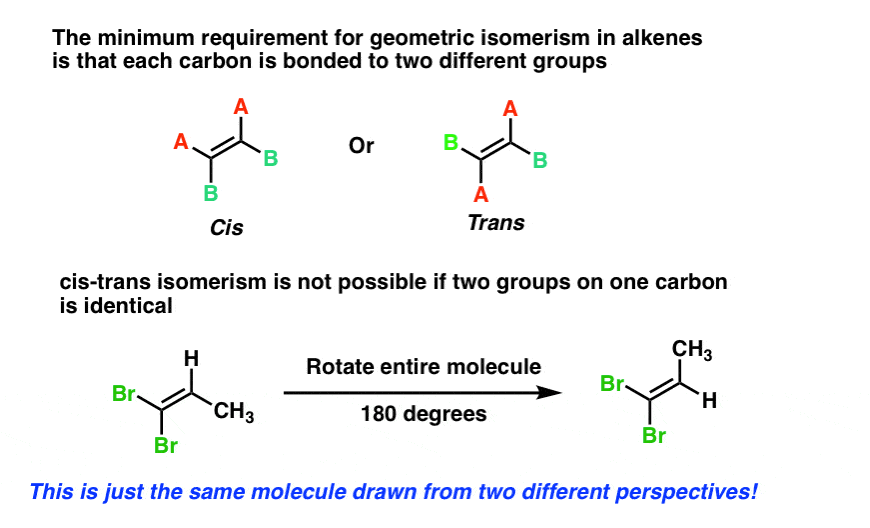
Wie bei Ringen besteht die Mindestanforderung an cis-trans-Isomerie in Alkenen darin, dass jeder Kohlenstoff an zwei verschiedene Gruppen gebunden ist und dass die beiden Kohlenstoffe mindestens einen Substituenten gemeinsam haben.
Wie bei Ringen ist eine cis-trans-Isomerie nicht möglich, wenn einer der Kohlenstoffkohlenstoffe der Doppelbindung an zwei identische Gruppen gebunden ist, wie unten bei 1,1-dibromo-1-propen. Probieren Sie es selbst aus, wenn Sie nicht überzeugt sind.,
3. Achten Sie auf mehrdeutige Namen, bei denen Cis / Trans-Isomerie möglich ist
Ein kurzer Exkurs: Eine Folge unserer neu entdeckten Wertschätzung der geometrischen Isomerie ist, dass viele einfach klingende Molekülnamen tatsächlich mehrdeutig sind.
Der Deskriptor „3-Hexen“ beschreibt beispielsweise kein bestimmtes Molekül eindeutig. . Um das spezifische Molekül festzunageln, müssen wir cis– oder trans– 3-Hexen angeben.,
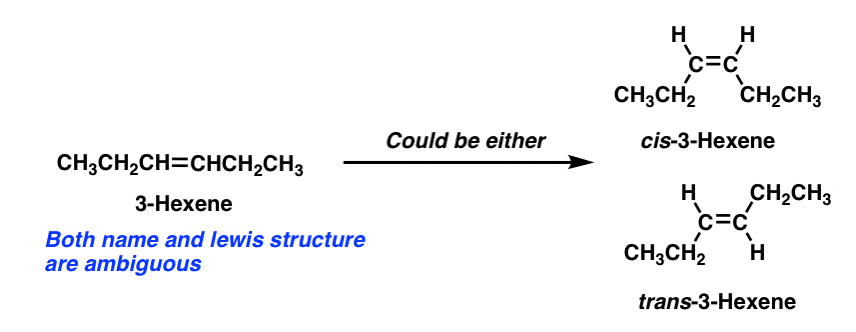
Beachten Sie, dass 1-Hexen immer noch in Ordnung ist, da die 1-Position von 1-Hexen an zwei identische Gruppen (Hydrogene) angehängt ist und somit keine cis–trans-Isomere möglich sind.
4. Cis-Trans-Isomerie für zyklische Alkene
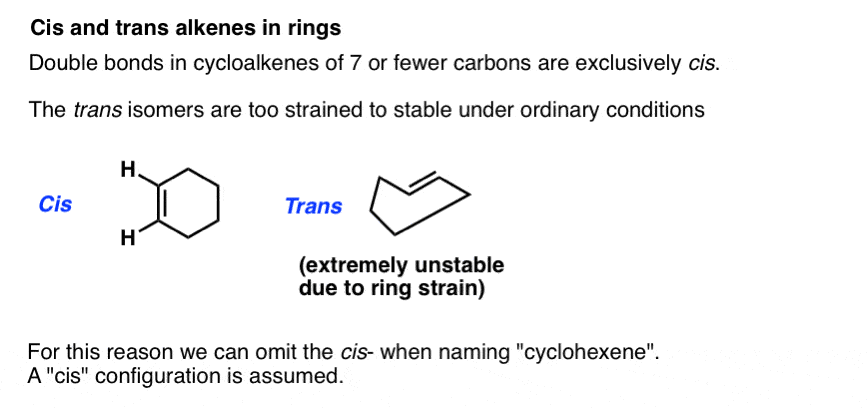
cis-und trans können auch auf Alkene in Ringen aufgebracht werden. Auf Papier ist es beispielsweise möglich, cis– und Trans– Cyclohexen zu zeichnen, da die pi – Bindung die Anforderungen an die cis – Trans-Isomerie erfüllt. In Wirklichkeit ist Trans-Cyclohexen unglaublich angespannt. Versuchen Sie, sich am Steißbein zu küssen., Das gibt Ihnen eine Vorstellung von der Belastung, die mit dem Versuch verbunden ist, eine Trans– Doppelbindung in einem sechsgliedrigen Ring unterzubringen .
Aus diesem Grund ist es bei Ringgrößen 7 und darunter sicher, das Schreiben von „cis“ zu ignorieren : Die Konfiguration wird angenommen.
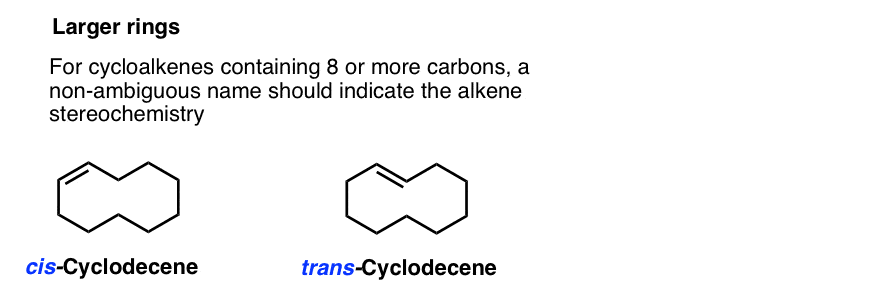
Bei Ringgrößen von 8 und höher müssen wir einen cis– oder trans – in den Namen einfügen, da das Trans– Isomer machbar wird. (Stellen Sie sich vor, Sie würden sich am Steißbein küssen, wenn Sie den Hals einer Giraffe hätten: plötzlich nicht unmöglich!,)
Eine Lösung Für die Als „Cis“ und „Trans“ Scheitert: Die E/Z-System
Wir sahen, dass cis-und trans schlägt fehl, in Ringen, wenn die beiden Kohlenstoffe fehlte eine gemeinsame Substituenten. Es scheitert auch für Alkene unter diesen Umständen.
Groß-und Kleinschreibung: Versuchen Sie, cis und trans auf das folgende Alken anzuwenden:
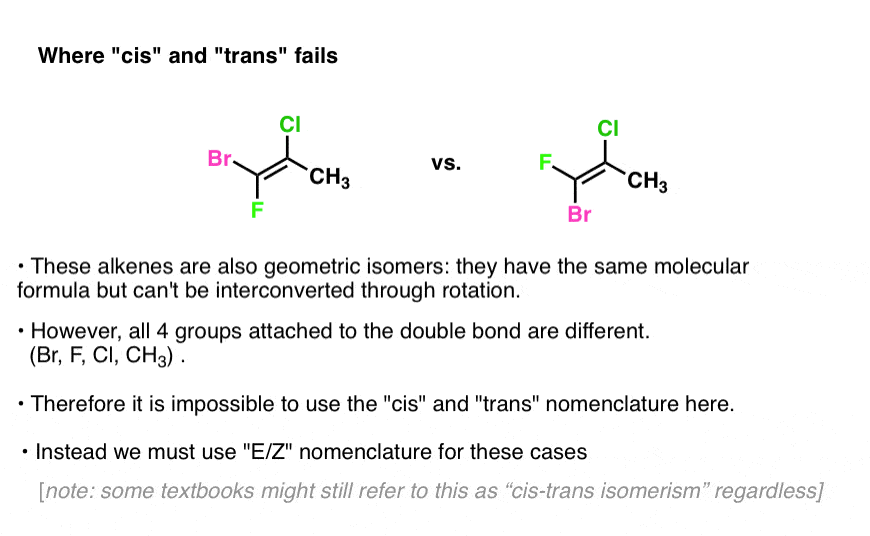
Siehe das Problem?
In Ermangelung zweier identischer Gruppen haben wir keinen Bezugspunkt!
Auf der linken Seite ist das Chlor cis zu Br und trans zu F. Aber rechtfertigt das wirklich, das Isomer „cis“ zu nennen ? Wie entscheiden wir?,
Was wir brauchen, ist eine Möglichkeit, Prioritäten in diesen Situationen zu bestimmen.
Die E-und Z-Notation für Alkene
Gott sei Dank können wir das von Cahn, Ingold und Prelog entwickelte Ranking-System für chirale Zentren anwenden (wie in diesem früheren Beitrag auf (R) / (S) Nomenklatur angesprochen) zu diesem Zweck.
Das Protokoll lautet wie folgt:
- Jeder Kohlenstoff in der pi-Bindung ist an zwei Substituenten gebunden. Für jeden Kohlenstoff werden diese beiden Substituenten (1 oder 2) nach den Ordnungszahlen des direkt an den Kohlenstoff angeschlossenen Atoms geordnet. (beispielsweise., Cl > F )
- Wenn sich beide Substituenten auf der gleichen Seite der pi-Bindung befinden, erhält die Bindung den Deskriptor Z (kurz für Deutsch Zusammen, was“zusammen“ bedeutet).
- Befinden sich beide Substituenten auf der gegenüberliegenden Seite der pi-Bindung, so erhält die Bindung den Deskriptor E (kurz für „Entgegengesetzt“).
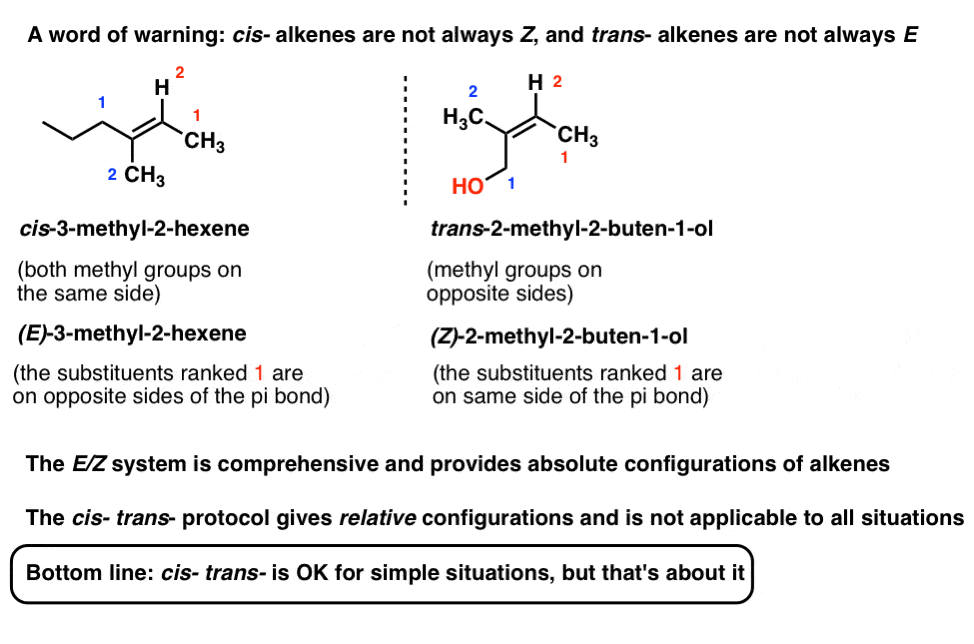
So gleicht Z „cis „und E gleicht“ trans“. (Hinweis: Sie sind nicht notwendigerweise gleich und korrelieren nicht immer: siehe Fußnote für ein Beispiel eines cis-Alkens, das E ist ., Das E / Z-System ist umfassend für alle Alkene, die zur geometrischen Isomerie fähig sind, einschließlich der obigen cis / Trans-Alken-Beispiele. Wir verwenden oft cis / trans für bequemlichkeit, aber E/Z ist die „offizielle“, IUPAC genehmigt weg zu name alkene stereoisomere].
Eine einfache Möglichkeit, sich an Z zu erinnern, besteht darin, „Zee Zame Zide“ mit deutschem Akzent zu sagen. Meine Art, es zu tun, war so zu tun, als ob das Z für „zis“steht. Was auch immer für dich funktioniert.,
Hier ist ein praktisches Beispiel:
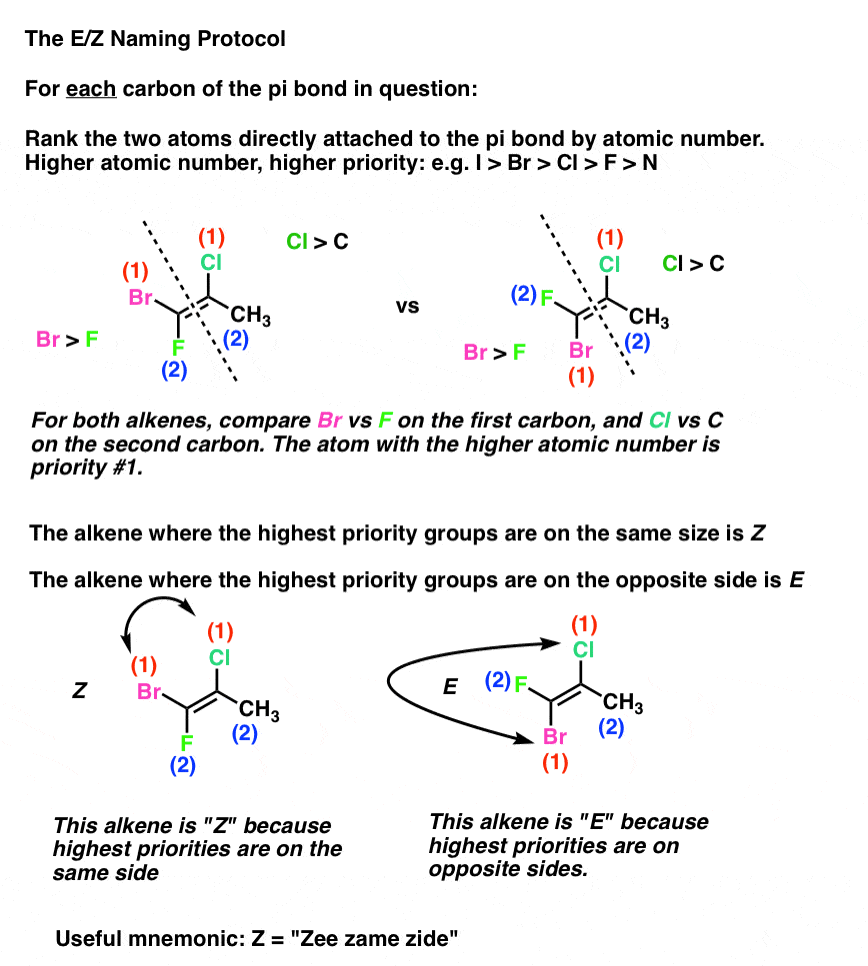
Wie bei chiralen Zentren kann eine Rangfolge nach Ordnungszahl zu Bindungen führen, wenn wir uns nur auf die Atome beschränken, die direkt an die pi-Bindungen gebunden sind.
7. Bindungen brechen: Die Methode der Punkte
Zum Beispiel stellt uns das folgende Alken vor ein Dilemma: Einer der Kohlenstoffkohlen des Algens ist an zwei Kohlenstoffatome gebunden. Wie bestimmen wir in diesem Fall Prioritäten? Wie brechen wir Bindungen?
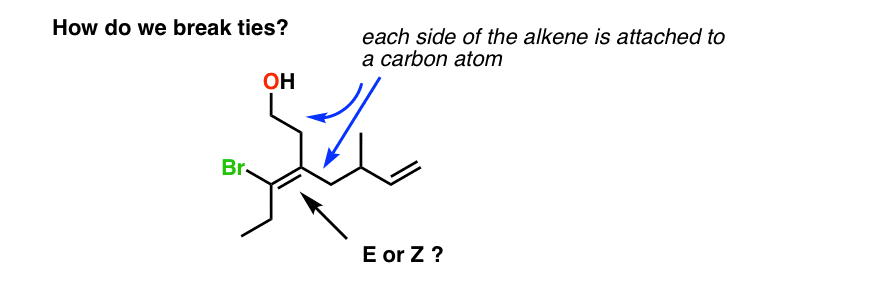
Bei Bindungen müssen wir die Methode der Punkte anwenden., Punkte sind praktische Platzhalter, weshalb ich diese Methode gerne verwende.
- Setzen Sie einen Punkt auf jedes der beiden Atome, die Sie vergleichen.
- Listen Sie die 3 Atome auf, an die jedes Atom in der Reihenfolge der Ordnungszahl angehängt ist.
- Vergleichen Sie die Listen, ähnlich wie Sie einen Satz von drei Spielkarten vergleichen würden. So wie eine Hand von (8, 8, 7) schlagen würde (8, 7, 7), so würde (C, C, H) schlagen (C, H, H).
- Wenn die Listen identisch sind, verschieben Sie die Punkte nach außen auf das Atom mit der höchsten Priorität in der Liste.
- Am ersten Differenzpunkt zuweisen (E oder Z).,
- Wenn es keinen Unterschied gibt… dann sind die Gruppen identisch und E / Z gilt nicht.
Hier ist ein praktisches Beispiel für die „Methode der Punkte“. 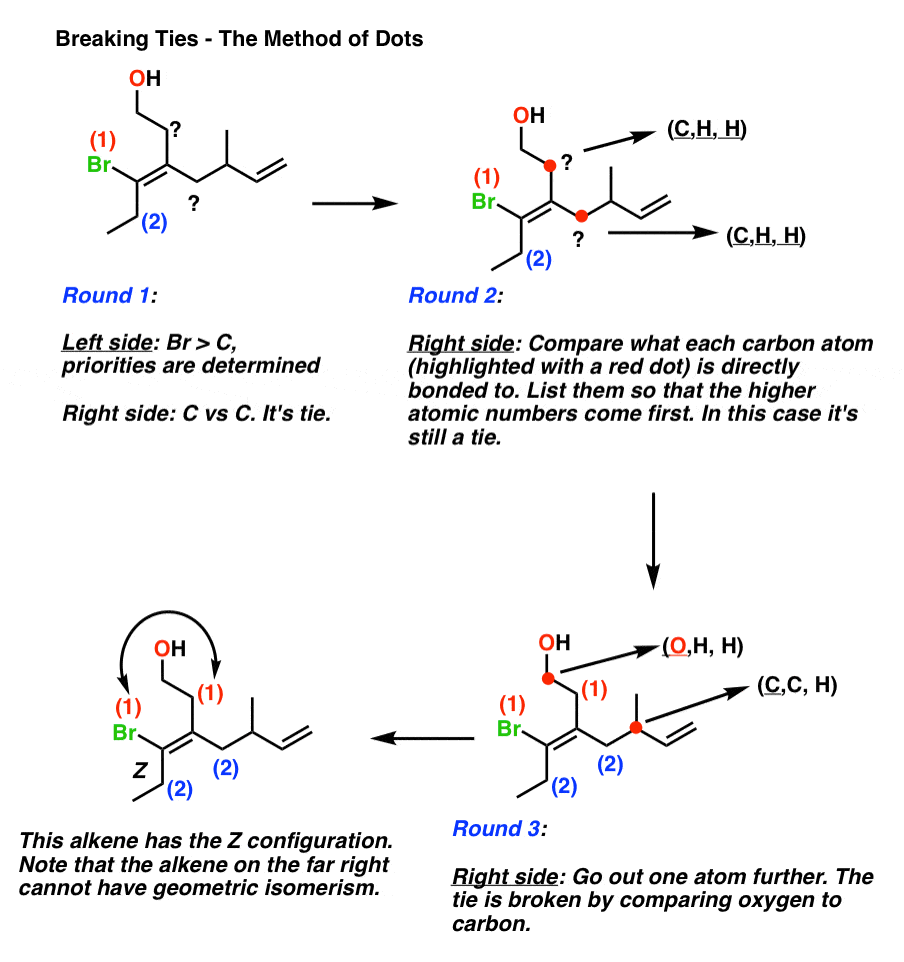
Hier ist ein komplexeres Beispiel mit mehreren Alkenen. In diesem Fall wird jede Pi-Bindung durch eine Zahl mit eigener separater E-oder Z-Konfiguration bezeichnet.
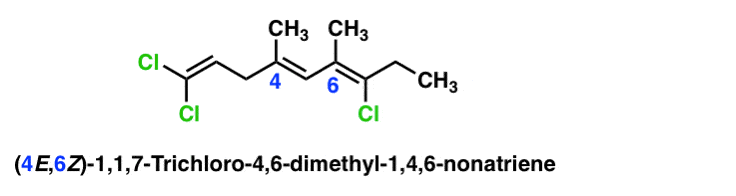
OK, das war lange. Aber hoffentlich nützlich.
Achten Sie auf einen zukünftigen Beitrag, in dem wir näher auf die „Methode der Punkte“eingehen.
8., Fazit: E-und Z-Notation Für Alkene
cis-trans – ist OK für die Beschreibung von einfachen Alken Stereoisomere, funktioniert aber nur in bestimmten Fällen. Darüber hinaus gibt es nur relative Konfigurationen. Die E/Z-system ist umfassend und beschreibt die absolute Konfiguration des Moleküls.
Siehe unten für ein Beispiel eines E-Alkens, das „cis“ ist, und eines Z-Alkens, das „trans“ist.
Nur zur Erinnerung: Dieser Beitrag wurde von Matt Pierce von Organic Chemistry Solutions mitverfasst. Fragen Sie Matt hier nach der Planung einer Online-Nachhilfe.,
Hinweise
Hinweis 1: Es ist möglich, ein Alken zu haben, das wir als ‚cis‘ be E und umgekehrt beschreiben würden.
E / Z ist die bevorzugte, umfassendere Nomenklatur, da sie die absolute Konfiguration beschreibt, während cis-trans-lediglich die relative Konfiguration beschreibt.
Hinweis 2: Transcyclopropen, Transcyclobuten und Transcyclopenten wurden nie synthetisiert oder beobachtet. trans-Cyclohexen ist ein Laborprodukt, das bei einigen Grad über dem absoluten Nullpunkt stabil ist. trans-Cyclohepten hat eine extrem kurze Halbwertszeit bei Raumtemperatur., Transcycloocten ist ein stabiles Molekül .
Quiz!,v>
 Click to Flip
Click to Flip
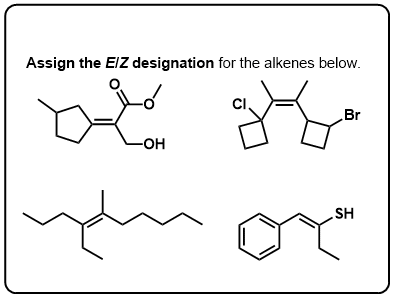 Click to Flip
Click to Flip
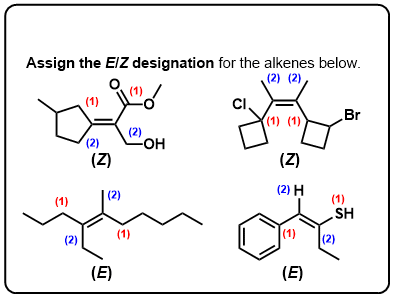 Klicken Sie, um
Klicken Sie, um
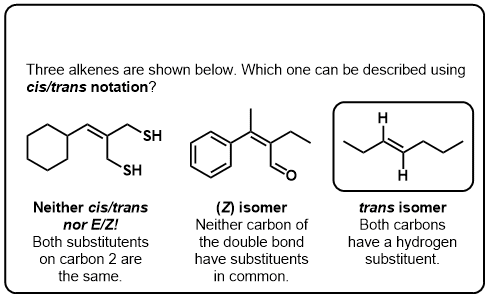
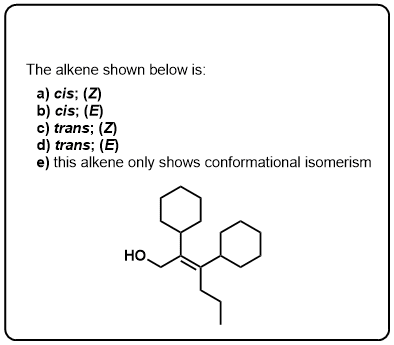 Click to Flip
Click to Flip

 Click to Flip
Click to Flip 
 Click to Flip
Click to Flip 

 Click to Flip
Click to Flip 