Einzigartige Chemie der Leichtesten Elemente
Die Chemie in der zweiten Periode element jeder Gruppe (n = 2: Li, Be, B, C, N, O und F) unterscheidet sich in vielen wichtigen Punkten von der des schwereren Mitglieder, oder verwandten, der Gruppe. Folglich sind die Elemente der dritten Periode (n = 3: Na, Mg, Al, Si, P, S und Cl) im Allgemeinen repräsentativer für die Gruppe, zu der sie gehören., Die anomale Chemie von Elementen der zweiten Periode ergibt sich aus drei wichtigen Merkmalen: kleinen Radien, energetisch nicht verfügbaren d-Orbitalen und einer Tendenz zur Bildung von pi (π) – Bindungen mit anderen Atomen.
Im Gegensatz zur Chemie der Elemente der zweiten Periode ist die Chemie der Elemente der dritten Periode repräsentativer für die Chemie der jeweiligen Gruppe.
Aufgrund ihrer kleinen Radien weisen Elemente der zweiten Periode Elektronenaffinitäten auf, die weniger negativ sind als aus allgemeinen periodischen Trends vorhergesagt., Wenn ein Elektron zu einem so kleinen Atom hinzugefügt wird, neigen erhöhte Elektronen–Elektronen-Abstoßungen dazu, das Anion zu destabilisieren. Darüber hinaus verhindern die geringen Größen dieser Elemente, dass sie Verbindungen bilden, in denen sie mehr als vier nächste Nachbarn haben. Somit bildet BF3 nur das Vierkoordinaten-tetraedrische BF4-Ion, während AlF3 unter den gleichen Bedingungen das Sechskoordinaten-oktaedrische AlF63-Ion bildet. Aufgrund der kleineren Atomgröße haben einfache binäre ionische Verbindungen von Elementen der zweiten Periode auch einen kovalenten Charakter als die entsprechenden Verbindungen, die aus ihren schwereren Kongeneren gebildet werden., Die sehr kleinen Kationen, die von Elementen der zweiten Periode abgeleitet sind, haben ein hohes Ladungs-Radius-Verhältnis und können daher die gefüllte Valenzhülle eines Anions polarisieren. Daher weist die Bindung in solchen Verbindungen eine signifikante kovalente Komponente auf, die den Verbindungen Eigenschaften verleiht, die sich signifikant von denen unterscheiden können, die für einfache ionische Verbindungen erwartet werden. Als Beispiel ist LiCl, das teilweise kovalent ist, viel löslicher als NaCl in Lösungsmitteln mit einer relativ niedrigen Dielektrizitätskonstante, wie Ethanol (ε = 25,3 gegenüber 80,1 für H2O).,
Da d-Orbitale niemals für Hauptquantenzahlen kleiner als 3 belegt sind, belegen die Valenzelektronen von Elementen der zweiten Periode nur 2s-und 2p-Orbitale. Die Energie der 3D-Orbitale übersteigt bei weitem die Energie der 2s-und 2p-Orbitale, so dass ihre Verwendung in der Bindung energetisch unerschwinglich ist. Folglich werden Elektronenkonfigurationen mit mehr als vier Elektronenpaaren um ein zentrales Element der zweiten Periode einfach nicht beobachtet. Sie erinnern sich vielleicht daran, dass die Rolle von d-Orbitalen bei der Bindung in Verbindungen der Hauptgruppe mit Koordinationszahlen von 5 oder höher etwas umstritten bleibt., Tatsächlich wurden theoretische Beschreibungen der Bindung in Molekülen wie SF6 veröffentlicht, ohne die Beteiligung von d-Orbitalen an Schwefel zu erwähnen. Argumente, die auf d-Orbitalverfügbarkeit und der geringen Größe des Zentralatoms basieren, sagen jedoch voraus, dass Koordinationszahlen größer als 4 für die Elemente der zweiten Periode ungewöhnlich sind, was mit experimentellen Ergebnissen übereinstimmt.,
Einer der dramatischsten Unterschiede zwischen den leichtesten Hauptgruppenelementen und ihren schwereren Kongeneren ist die Tendenz der Elemente der zweiten Periode, Arten zu bilden, die mehrere Bindungen enthalten. Zum Beispiel liegt N in Gruppe 15 knapp über P: N2 enthält eine N≡N-Bindung, aber jedes Phosphoratom in tetraedrischem P4 bildet drei P–P-Bindungen. Dieser Unterschied im Verhalten spiegelt die Tatsache wider, dass sich innerhalb derselben Gruppe des Periodensystems die relativen Energien der π-Bindung und der sigma-Bindung (σ) unterscheiden. Eine C=C-Bindung ist beispielsweise etwa 80% stärker als eine C-C-Bindung., Im Gegensatz dazu ist eine Si=Si-Bindung mit geringerer p-Orbitalüberlappung zwischen den Valenzorbitalen der gebundenen Atome aufgrund der größeren Atomgröße nur etwa 40% stärker als eine Si–Si-Bindung. Folglich sind Verbindungen, die sowohl mehrfache als auch einzelne C-bis C-Bindungen enthalten, für Kohlenstoff üblich, aber Verbindungen, die nur Sigma–Si-Bindungen enthalten, sind energetisch günstiger für Silizium und die anderen Elemente der dritten Periode.,
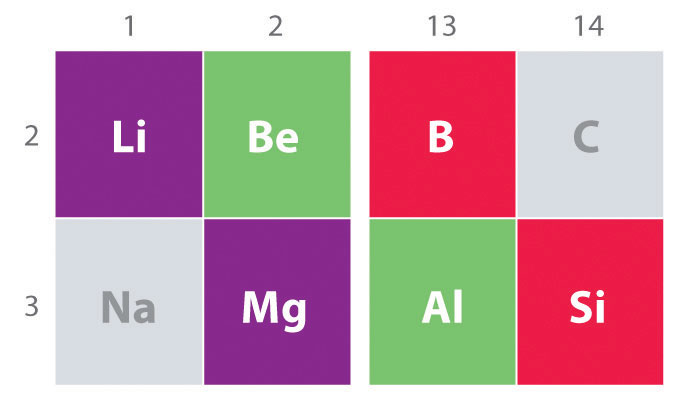
Ein weiterer wichtiger Trend in der Hauptgruppenchemie ist die chemische Ähnlichkeit zwischen dem leichtesten Element einer Gruppe und dem Element unmittelbar darunter und rechts davon in der nächsten Gruppe, ein Phänomen, das als Diagonaleffekt bekannt ist (Abbildung \(\pageIndex{2}\)) Es gibt beispielsweise signifikante Ähnlichkeiten zwischen der Chemie von Li und Mg, Be und Al und B und Si. Sowohl BeCl2 als auch AlCl3 haben einen wesentlichen kovalenten Charakter, so dass sie in unpolaren organischen Lösungsmitteln etwas löslich sind., Im Gegensatz dazu verhält sich MgCl2, obwohl Mg und Be in derselben Gruppe sind, aufgrund der geringeren Elektronegativität und der größeren Magnesiumgröße wie ein typisches ionisches Halogenid.