er Skabt af MakeTheBrainHappy.
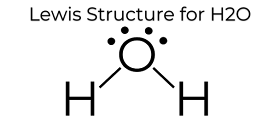
H2O Le .is Dot struktur giver det mange unikke egenskaber hovedsagelig på grund af de to ensomme par på det centrale O .ygenatom. Dette øger elektron-elektronafstødning og skaber derfor en bøjet struktur i modsætning til CO2 ‘ s lineære struktur. Denne” bøjede ” molekylære struktur giver den mange unikke egenskaber, såsom at være polær., Et af de mest fascinerende fænomener er ideen om “hydrogenbinding”, som påvirker vandets egenskaber dramatisk.
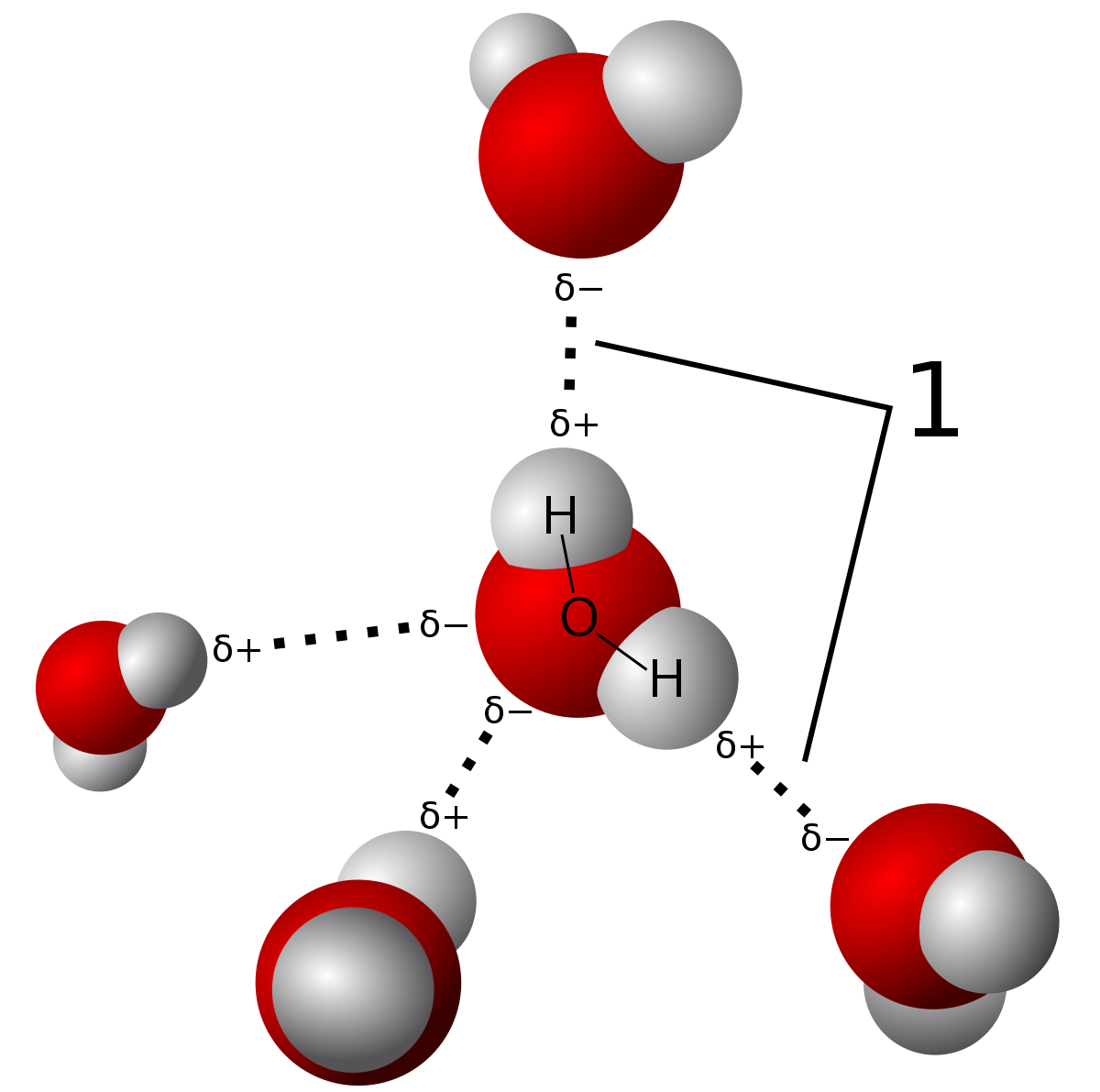
Hydrogen-binding er en type af intermolekylære force, hvor forskellen i elektronegativiteten ilt atom forårsager en delvis permanent dipol til at danne mellem brint-og ilt-atomer (vist i den stiplede linjer). Bindingerne i selve vandmolekylet er kovalente bindinger. Du kan lære om forskellen i dette indlæg., Kilde
på grund af styrken af disse hydrogenbindinger har vand et relativt højt smeltepunkt og kogepunkt, selvom de ikke er så høje som netværkskovalente faste stoffer. Disse er bundet af intramolekylære kræfter, der involverer den faktiske deling af elektroner vs. partielle dipolkræfter i hydrogenbindinger. Der er kun tre typer bindinger, der kan hydrogenbinding. Disse er N-H -, O-H-og F-H-bindinger på grund af de store elektronegativitetsforskelle mellem molekylerne.,
NH3 er et andet molekyle, der skaber lignende hydrogenbindinger som H2O. Source
hvilke andre egenskaber har vand?
Vand er et af de eneste elementer, der findes i alle tre tilstande (Fast, Flydende og gasformig) naturligt på jorden. Hydrogenbinding forårsager en krystallinsk struktur, der gør den mindre tæt end flydende vand. Derfor flyder is i oceanerne. Vand har også en høj overfladespænding og vedhæftning., Samhørighed og vedhæftning er afgørende for planter, der manipulerer disse processer for at flytte vand fra rødderne til bladene for at understøtte plantens vækst. Alt dette skyldes den enkle struktur af H2O, repræsenteret af Le .is Dot diagrammet ovenfor.

vandmolekyler i alle tre tilstande af stof. Kilde