Indledning
Corona virus, SARS-CoV-2 har allerede spredt sig rundt i hele verden og er i øjeblikket, med ingen vaccine tilgængelig endnu, ustoppelig. I dag påvirker COVID-19 mere end 3,000,000 bekræftede patienter globalt. Første linje medicin er antivirale lægemidler og flere presserende kliniske forsøg er i gang., Et nyligt klinisk forsøg med HIV-proteasehæmmerkombinationen lopinavir og ritonavir viste imidlertid ingen signifikant antiviral aktivitet mod SARS-cov-2 hos patienter med svær sygdom (1). Så længe vi ikke har specifikke antivirale terapier mod SARS-cov-2, er vi nødt til at yde understøttende symptomatiske terapier for at forhindre lungesvigt, den mest almindelige årsag til covid-19-dødelighed.,
type II alveolære celler er beskadiget af SARS-cov-2
virusinfektion, og den resulterende alveolære celledestruktion tiltrækker immunceller med en overdreven alveolær e .udativ og interstitiel inflammatorisk reaktion. En storm af cytokin-og kemokinproduktion resulterer i ødelæggelse af lungevæv og i sidste ende i alvorligt akut åndedrætssyndrom (ARDS). SARS-cov-2 såvel som SARS-cov trænger ind i cellerne gennem den angiotensin-konverterende en .ymreceptor 2 (ACE2)., ACE2 udtrykkes stærkt på den apikale overflade af luftvejsepithelia, vaskulær endothelia, nyre-og kardiovaskulært væv samt forskellige andre celler (2). Når de kommer ind gennem luftvejene, kan SARS-cov og SARS-cov-2 specifikt ødelægge celler, som overvejende udtrykker ACE2-receptoren på deres overflader, nemlig type II alveolære celler (2, 3).
som stamceller til det alveolære epitel er type II alveolære celler “forsvareren af alveolus” (4)., De opretholder alveolær homeostase, især efter mikrobiel lungeskade, hvor de kontrollerer den inflammatoriske respons.
gennem deres produktion af det beskyttende lungesurfactant reducerer alveolære celler af type II lungeoverfladespændingen og letter således vejrtrækning og gasudveksling og er desuden centrale for reparationsprocesser efter traumer (5) (Figur 1). Skader på alveolære celler af type II reducerer drastisk produktion af pulmonalt overfladeaktivt stof og sekretion til det alveolære rum., Dette efterfølges af atelektase på grund af dysfunktion af lungesensid, der yderligere reducerer lungeoverholdelse (6). Luft-væske-interfasen forstyrres hos SARS-cov-2-inficerede patienter, hvilket fører til lungeskader. ACE2 selv beskytter mod lungeskade selvom anti-inflammatoriske og anti-fibrotiske mekanismer. Anvendelsen af rekombinant angiotensin-konverterende en .ym (ACE) ville således ikke kun blokere virusreceptorbindingssteder, men også give lungebeskyttelse. I scenariet, hvor SARS-cov-2 binder til ACE2, reduceres beskyttende ACE-binding kraftigt., Ødelæggelsen af alveolære celler efterfølges af reduceret iltning i blodet, lungefibrose, ødem, nedsat regenerering og i sidste ende fører til respirationssvigt (7).
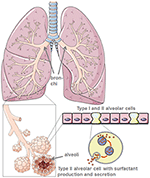
Figur 1. Model af lunge og alveolær morfologi. Lunge overfladeaktivt middel fremstilles af type-II-alveolære celler. Oprettet ved hjælp af smart servier medical art under https://creativecommons.org/licenses/by/3.0/.,
Lunge Overfladeaktivt Beskyttende Anti-Inflammatoriske ARDS Terapi
respirationssvigt er også kendt fra en helt anden oprindelse, nemlig i for tidligt fødte spædbørn med nedsat lunge overfladeaktive produktion i forhold til den term-født børn. Uden tilstrækkeligt lungetensid kollapser alveolerne under udånding, hvilket resulterer i dårlig blodo .ygenering.
lungeoverflader viser luft-væske-interfasen og er i konstant bevægelse under Ind – og udånding. Sidstnævnte giver risikoen for vævskollaps på grund af væskeoverfladespænding., Lungen overvinder denne fare ved at dække overfladen med lunge overfladeaktivt middel. Lungesurfactant produceres i specialiserede celler, der findes i de terminale lungegrener, type II alveolære celler, der begynder at producere lungesurfactant umiddelbart efter fødslen (8).
Lunge-overfladeaktive stoffer, der er en blanding af fosfolipider, og fire overfladeaktive stoffer proteiner (SP), nemlig den hydrofile SP A og SP-D, også kaldet collectins, og lipofile SP-B og SP-C (9). Lunge overfladeaktivt middel sænker overfladespændingen og forhindrer derved det alveolære sammenbrud under udånding., Alle SP bidrager til lungens medfødte immunresponser, mens SP-B og SP-c også påvirker konsistensen af det phospholipidrige overfladeaktive stof (10). For nylig blev nye overfladeaktive associerede proteiner (SFTA) beskrevet med lignende egenskaber sammenlignet med den “klassiske” SP (11-13). SFTA2 er hydrofil og har lignende egenskaber sammenlignet med SP-A og SP – D (13). SFTA3 øger fagocytose af makrofag cellelinier (14) og er et amfifilt protein (12)., Derfor vil det sandsynligvis være til stede i de kommercielt tilgængelige lipofile ekstraktioner af dyre lunger og kunne forbedre den fagocytotiske aktivitet af makrofager mod cov-2.
hos premature spædbørn er produktionen af overfladeaktivt stof i lungerne utilstrækkelig med dårlig iltning i blodet og høj alveolær overfladespænding, hvilket fører til øget inflammatorisk reaktion.
fra slutningen af halvfjerdserne blev eksogent bovint eller svinelung overfladeaktivt middel afledt af bronchial skylning med succes etableret som en terapi for ARDS hos premature spædbørn., Behandling med lunge overfladeaktive præparater fører til øget iltning og øget overlevelse (15-17). Det bemærkes, at behandling med naturligt forekommende lungesurfactant havde et bedre resultat med hensyn til spædbørns overlevelse sammenlignet med syntetisk lungesurfactant (17). Naturlige lunge overfladeaktive stoffer er en blanding af lipider (90%) og overfladeaktive proteiner (10%), som regulerer aktiviteten af alveolære makrofager og reducerer inflammation. Den lipofile lunge overfladeaktive fraktion har antiinflammatoriske egenskaber, når den påføres intratrachealty til lungen (18) såvel som topisk på huden (19)., I huden reducerer lungesurfactant ekspressionen af proinflammatoriske og profibrotiske gener i sår in vivo. I forskellige in vitro og in vivo murine og humane modeller af sår, betændelse, lunge overfladeaktive stoffer reduceret TNF-α, TACE og IL-6 (19), der er stærkt forhøjede i hårdt ramt COVID-19 patienter.
nylige fund viser, at SARS-cov-2 inducerer ødelæggelse af type II alveolære celler i covid-19-associeret lungebetændelse (2). Præcis disse celler producerer lunge overfladeaktivt middel og forhindre lungekollaps., Endvidere er lymfocytopeni med massiv frigivelse af cytokiner en anden faktor, der fører til lungesvigt og død i alvorlige tilfælde af COVID-19-patienter. Derfor er antiinflammatoriske mål såsom anti-TNF og anti-IL-6 blevet foreslået for bedre at kontrollere alvorlig COVID-19-infektion (20).,
Diskussion: Brug af Lunge Overfladeaktivt stof til Pulmonal Barriere Restaurering i Patienter Med COVID-19 Lungebetændelse
Selv om lunge overfladeaktivt stof terapi er den standard, meget sikker og effektiv behandling af nyfødte med ARDS, behandling med rekombinant SP-C, der er baseret overfladeaktive stoffer har ikke vist forbedret overlevelse i større randomiserede, kontrollerede forsøg hos voksne (18). Det er vigtigt, at brugen af naturlige overfladeaktive stoffer synes at være fordelagtig sammenlignet med syntetiske overfladeaktive stoffer (16, 17) med signifikant forbedring i blodo .ygenering og kortere ventilationstid hos spædbørn (16)., Meconium aspirationssyndrom ligner covid-19 lungebetændelse med reduceret produktion og destruktion af overfladeaktive stoffer af type II alveolære celler (21). Tidlig administration af naturligt lungesurfactant reducerede ECMO-Terapi og ventilationstid (21). Dette antyder, at tidlig indgivelse af naturligt lungesurfactant faktisk kunne forbedre lungefunktionen også hos voksne patienter med svær ARDS, mens dødsårsagen muligvis ikke er den kollapsede lunge alene, men snarere en multiorgansvigt., Desuden indebærer forskellige risikofaktorer for udvikling af ARDS og forskellige fænotyper mulige forskellige effekter på grund af terapeutiske foranstaltninger. Således kan gavnlige virkninger af overfladeaktiv terapi hos COVID-19-associerede ARDS-patienter tænkes, især når de anvendes tidligt i behandlingsstrategien mod lungesvigt.,
på Grund af den robuste anti-inflammatoriske og lunge beskyttende effekt, og i dag er presserende behov for lunge-støttende terapi, foreslår vi, at den adjuverende behandling af COVID-19 lungebetændelse patienter på ICUs med naturlige lunge-overfladeaktive stoffer, der ud over at den nuværende standard af ARDS intensiv behandling. Nuværende bevis tyder på, at dette ville øge iltningen i blodet, reducere lungeødem og forbedre den overdrevne inflammatoriske reaktion, der findes i lungeopsier hos COVID-19 patienter (22)., Windindtree therapeutics announced annoncerede deres plan om at teste KL4, et syntetisk overfladeaktivt middel, hos svære COVID-19-inficerede patienter (https://www.windtreetx.com/). I Tyskland, Lyomark Pharma GmbH er planlægning for at teste deres naturlige multicomponent lunge overfladeaktivt stof bovactant i voksen COVID-19 patienter med lungebetændelse, samt (www.lyomark.com).
Kommercielt tilgængelige lunge overfladeaktivt stof er relativt billigt for ICU standarder, let tilgængelige og har ingen kendte bivirkninger hos børn og voksne., Der bør udvises forsigtighed hos patienter med kendt allergi mod kvæg eller svin produkter, som lunge overfladeaktive stoffer er for det meste høstet fra kvæg (bovactant, Alveofact®) eller svin (poractant alfa, Curosurf®) lunger ved lavage eller væv hakning efterfulgt af ekstraktion af lipid brøkdel.
indgivelse er enkel ved at tilsætte det rekonstituerede lyofiliateat i trachealrøret i den ventilerede patient, der leverer lægemidlet direkte til det alveolære rum. Med hensyn til bovactant blev en forstøver for nylig godkendt til klinisk brug i USA af FDA., Ved at dække den ydre overflade af alveoler virker lunge overfladeaktivt middel direkte på inflammatoriske celler, hvilket reducerer cytokinproduktion og vævsødelæggelse. Derved gendanner den lungebarrieren og forhindrer således lungekollaps (figur 2). Derfor vil det reducere varigheden af ventilationsterapi, lette vejrtrækningen og dermed bidrage til patienternes genopretning.
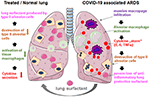
Figur 2. Hypotetisk mekanisme for eksternt anvendt lungesurfactant til lungebeskyttelse i svære covid-19-associerede ARDS., COVID-19 forbundet ARDS er præget af massive macrophage infiltration, væv alveolære macrophage aktivering og en potensering af cytokin produktion i lungerne (cytokin “storm”), som fører til ødelæggelse af overfladeaktive stoffer og producere type II alveolære celler, som forværrer situationen ved tab af anti-inflammatoriske, anti-fibrotisk lunge overfladeaktivt stof. Eksogent overfladeaktivt middel kan reducere inflammation og dermed genoprette pulmonal overlevelse. Oprettet ved hjælp af smart servier medical art under https://creativecommons.org/licenses/by/3.0/.,
Forfatterbidrag
alle forfattere bidrog til design, skrivning og konceptualisering af manuskriptet. UM Og KM redigeret og designet figurerne.
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
Vi vil gerne takke Desiree Schumann (University of Basel) for hendes indsigtsfulde støtte til at skrive dette manuskript., Forfattere er støttet af den tyske Research Foundation (DFG) og JDRF. Vi ønsker at undskylde for ikke at citere mange vigtige publikationer på grund af pladsbegrænsninger.
9. Bernhard Lung. Lung overfladeaktivt stof: funktion og sammensætning i forbindelse med udvikling og respiratorisk fysiologi. Ann Anat. (2016) 208:146–50. doi: 10.1016/j.aanat.2016.08.003
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
10. Wright JR., Den” visdom ” af lunge overfladeaktivt stof: balancering vært forsvar og overfladespænding-reducerende funktioner. Am J Physiol Lungecelle Mol Physiol. (2006) 291:L847–50. doi: 10.1152/ajplung.00261.2006
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin A, et al. SFTA3-et nyt overfladeaktivt protein af den okulære overflade og dens rolle i hornhinden sårheling og rive film overfladespænding. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. Surfactant therapy hos præmature børn med respiratorisk distress syndrom og i nær-eller sigt nyfødte med akut RDS. J Perinatol. (2006) 26 (Suppl. 1):S51–6; diskussion S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
16. Været JV, Zimmermann LJ. Hvad er nyt i overfladeaktivt stof? Et klinisk syn på den seneste udvikling inden for neonatologi og pædiatri. Europ-J Pediatrics. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumactant og poractant alfa til behandling af respiratorisk distress syndrom hos nyfødte født ved 25-29 ugers drægtighed: et randomiseret forsøg. Lancet. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar