Úvod
Corona virus SARS-CoV-2 se již rozšířil po celém světě a je v současné době žádná vakcína zatím k dispozici, nezastavitelný. COVID-19 postihuje celosvětově více než 3 000 000 potvrzených pacientů. Léky první linie jsou antivirotika a probíhá několik naléhavých klinických studií., Nicméně, nedávné klinické studie testování HIV proteázy kombinace lopinaviru a ritonaviru ukázal žádnou významnou antivirovou aktivitu proti SARS-CoV-2 u pacientů s těžkým onemocněním (1). Dokud nemáme specifické antivirové terapie proti SARS-CoV-2, musíme poskytnout podpůrné symptomatické terapie, abychom zabránili plicnímu selhání, nejčastější příčině úmrtnosti COVID-19.,
Typu II Alveolární Buňky Jsou Poškozeny tím, SARS-COV-2
Virové infekce a výsledný alveolární destrukce buněk lákají imunitní buňky s nadměrnou alveolární exsudativní a intersticiální zánětlivé reakce. Bouře cytokinů a chemokinový výsledky výroby v plicní tkáni ničení a nakonec v těžké akutní respirační tísně (ARDS). SARS-CoV – 2 a SARS-CoV vstupují do buněk prostřednictvím receptoru enzymu konvertujícího angiotensin 2 (ACE2)., ACE2 je vysoce exprimován na apikální povrchu epitelu dýchacích cest, cévní endotelových buněk, renální a kardiovaskulární tkáně, stejně jako různé jiné buňky (2). Jak vstupují do dýchacího traktu, SARS-CoV a SARS-CoV-2 mohou specificky zničit buňky, které převážně exprimují receptor ACE2 na svých površích, jmenovitě alveolární buňky typu II (2, 3).
jako progenitorové buňky pro alveolární epitel jsou alveolární buňky typu II „obráncem alveolu“ (4)., Udržují alveolární homeostázu, zejména po mikrobiálním poškození plic, kde kontrolují zánětlivou odpověď.
Přes jejich výrobu ochranných plic povrchově aktivní látky, typu II alveolární buňky snížit plic, povrchové napětí a tím usnadňují dýchání a výměnu plynů, a kromě toho jsou centrální pro opravy procesy po traumatu (5) (Obrázek 1). Poškození alveolárních buněk typu II drasticky snižuje produkci plicních povrchově aktivních látek a sekreci do alveolárního prostoru., Následuje atelektáza způsobená dysfunkcí plicních povrchově aktivních látek, která dále snižuje plicní shodu (6). Vzduch-kapalina-interfáza je narušena u pacientů infikovaných SARS-CoV – 2, což vede k poškození plic. ACE2 sám chrání před poškozením plic, i když protizánětlivé a anti-fibrotické mechanismy. Použití rekombinantního enzymu konvertujícího angiotensin (ACE) by tedy nejen blokovalo vazebná místa virových receptorů, ale také poskytovalo ochranu plic. Ve scénáři, kdy se SARS-CoV-2 váže na ACE2, je ochranná vazba ACE výrazně snížena., Po destrukci alveolárních buněk následuje snížená okysličení krve, plicní fibróza, edém, zhoršená regenerace a nakonec vede k selhání dýchání (7).
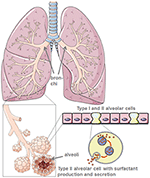
Obrázek 1. Model plicní a alveolární morfologie. Plicní povrchově aktivní látka je produkována alveolárními buňkami typu II. Vytvořeno pomocí smart servier medical art pod https://creativecommons.org/licenses/by/3.0/.,
Plicní Surfaktant jako Ochranné Protizánětlivé Terapie ARDS
Respirační selhání je známý také ze zcela jiného původu, zejména u předčasně narozených dětí se sníženou plicní povrchově aktivní produkce v porovnání k termínu narozených dětí. Bez dostatečného plicního povrchově aktivního činidla se alveoly během výdechu zhroutí, což vede ke špatné okysličení krve.
plicní povrchy zobrazují vzduch-kapalinu-mezifázu a jsou v neustálém pohybu během in – a výdechu. Ten poskytuje riziko zhroucení tkáně v důsledku povrchového napětí kapaliny., Plíce překonávají toto nebezpečí zakrytím povrchu plicním povrchově aktivním činidlem. Plicní povrchově aktivní látky se vyrábí ve specializovaných buňkách nacházejí v terminálu plic větví, typu II alveolární buňky, které začnou produkovat povrchově ihned po narození (8).
Plicní surfaktant je směs fosfolipidů a čtyři povrchově aktivní proteiny (SP), a to hydrofilní SP-a a SP-D, také volal collectins, a lipofilní SP-B a SP-C (9). Plicní povrchově aktivní látka snižuje povrchové napětí a tím zabraňuje alveolárnímu kolapsu během výdechu., Všechny SP přispívají k vrozeným imunitním reakcím plic, zatímco SP-B a SP-C ovlivňují konzistenci povrchově aktivní látky bohaté na fosfolipid (10). V poslední době, román surfaktant proteinů (SFTA) byla popsána s podobnými vlastnostmi ve srovnání s „klasickým“ SP (11-13). SFTA2 je hydrofilní a vykazuje podobné vlastnosti ve srovnání s SP-A a SP-D (13). SFTA3 zvyšuje fagocytózu buněčných linií makrofágů (14) a je amfifilní protein (12)., Proto je pravděpodobné, že bude přítomen v komerčně dostupných lipofilních extrakcích zvířecích plic a může zvýšit fagocytotickou aktivitu makrofágů proti CoV-2.
předčasně narozených dětí, plicní surfaktant výroba je nedostatečná, špatné okysličení krve a vysoký alveolární povrchové napětí, což vede ke zvýšení zánětlivé reakce.
od konce sedmdesátých let byla exogenní hovězí nebo prasečí plicní povrchově aktivní látka získaná z bronchiální výplachy úspěšně zavedena jako terapie ARDS u předčasně narozených dětí., Léčba přípravky plicních povrchově aktivních látek vede ke zvýšené okysličení a zvýšenému přežití (15-17). Z vědomí, zacházení s přirozeně se vyskytující plicní surfaktant měli lepší výsledek s ohledem na kojenecké přežití ve srovnání s syntetické plic povrchově aktivní látky (17). Přírodní plicní povrchově aktivní látky jsou směsí lipidů (90%) a povrchově aktivních proteinů (10%), které regulují aktivitu alveolárních makrofágů a snižují zánět. Lipofilní frakce plicních povrchově aktivních látek má protizánětlivé vlastnosti při aplikaci intratracheálně do plic (18) i lokálně na kůži (19)., V kůži plicní povrchově aktivní látka snižuje expresi prozánětlivých a pro-fibrotických genů v ranách in vivo. V různých in vitro a in vivo na myších a lidských modelech hojení zánětu, plicní surfaktant snižuje TNF-α, TACE a IL-6 (19), které jsou vysoce pokročilí v těžce postižených COVID-19 pacientů.
nedávné nálezy ukazují, že SARS-CoV-2 indukuje destrukci alveolárních buněk typu II u pneumonie spojené s COVID-19 (2). Přesně tyto buňky produkují plicní povrchově aktivní látku a zabraňují kolapsu plic., Kromě toho je lymfocytopenie s masivním uvolňováním cytokinů dalším faktorem vedoucím k plicnímu selhání a smrti v závažných případech pacientů COVID-19. Proto byly navrženy protizánětlivé cíle, jako jsou anti-TNF a anti-IL-6, pro lepší kontrolu závažné infekce COVID-19 (20).,
Diskuse: Použití Plicní Surfaktant pro Plicní Bariéry Obnovy u Pacientů S COVID-19 zápal Plic
i když plicní povrchově aktivní terapie je standardní, velmi účinná a bezpečná terapie pro novorozenců s ARDS, léčba rekombinantním SP-C založené povrchově aktivní látky neprokázaly zlepšení přežití ve velkých randomizovaných kontrolovaných studií u dospělých (18). Důležitější je, že použití přírodních povrchově aktivních látek, zdá se být výhodné, ve srovnání se syntetickými tenzidy (16, 17) s významné zlepšení okysličení krve a kratší doba větrání u kojenců (16)., Syndrom aspirace mekonia připomíná pneumonii COVID-19 se sníženou produkcí povrchově aktivních látek a destrukcí alveolárních buněk typu II (21). Včasné podávání přírodního povrchově aktivního činidla plic snížilo dobu ECMO terapie a ventilace (21). To naznačuje, že časné podávání přírodní plic povrchově aktivní látky by mohla skutečně zlepšit plicní funkce i u dospělých pacientů s těžkým ARDS, zatímco příčina smrti nemusí být plíci sám, ale spíše multi-orgánové selhání., Kromě toho různé rizikové faktory pro vývoj ARDS a různých fenotypů znamenají možné různé účinky v důsledku terapeutických opatření. Tak, blahodárné účinky povrchově aktivní terapie v COVID-19 souborům ARDS u pacientů jsou možné, a to zejména při použití v léčbě strategie proti plicní selhání.,
díky robustní anti-pobuřující a plic, ochrannou účinnost a dnes je naléhavou potřebu plic podpůrná terapie, navrhujeme adjuvantní léčbě COVID-19 pneumonie u pacientů na jednotkách intenzivní péče s přírodní plic povrchově aktivní látky, navíc k aktuálním standard ARDS intenzivní péče. Současné důkazy naznačují, že se tím zvýší okysličení krve, snížení plicní edém, a zmírnit nadměrné zánětlivé reakce našel v plicní pitvy COVID-19 pacientů (22)., Windtree therapeutics™ oznámil svůj plán testovat KL4, syntetickou povrchově aktivní látku, u těžkých pacientů infikovaných COVID-19 (https://www.windtreetx.com/). V Německu, Lyomark Pharma GmbH mají v plánu testovat jejich přírodní vícesložkové plicní surfaktant bovactant u dospělých COVID-19 pacientů s pneumonií (www.lyomark.com).
Komerčně dostupné plicní surfaktant je relativně levná pro JIP norem, snadno k dispozici a nemá žádné známé vedlejší účinky u dětí a dospělých., Opatrnosti je třeba u pacientů se známou alergií proti skotu nebo prasat produkty, jako plicní povrchově aktivní látky jsou většinou sklizena z hovězího dobytka (bovactant, Alveofact®) nebo prasat (poractant alfa, Curosurf®) plic výplach nebo tkáně mletí následuje extrakce lipidové frakce.
podání je jednoduché přidáním rekonstituovaného lyofilizátu do tracheální trubice větraného pacienta, který dodává lék přímo do alveolárního prostoru. Pokud jde o bovaktant, nebulizátor byl nedávno schválen pro klinické použití v USA FDA., Zakrytím vnějšího povrchu alveol působí povrchově aktivní látka plic přímo na zánětlivé buňky, které snižují produkci cytokinů a destrukci tkáně. Tím obnovuje plicní bariéru a tím zabraňuje kolapsu plic (Obrázek 2). V důsledku toho zkrátí dobu trvání ventilační terapie, usnadní dýchání a přispěje tak k zotavení pacientů.
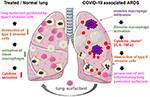
Obrázek 2. Hypotetický mechanismus externě aplikovaného plicního povrchově aktivního činidla pro plicní ochranu u těžkých ARDS spojených s COVID-19., COVID-19 souborům ARDS je charakterizován masivní infiltrace makrofágů, tkání, alveolárních makrofágů aktivace a potenciaci produkce cytokinů v plicích (cytokin „bouře“), což vede ke zničení povrchově aktivní látky produkující typu II alveolární buňky, které zhoršuje situaci přes ztrátu anti-pobuřující, anti-fibrotické plicní povrchově aktivní látky. Exogenní povrchově aktivní látka může snížit zánět a tím obnovit plicní přežití. Vytvořeno pomocí smart servier medical art pod https://creativecommons.org/licenses/by/3.0/.,
Autor Příspěvky
Všichni autoři přispěli k designu, psaní a pojímání rukopisu. UM A KM upravil a navrhl postavy.
střet zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
poděkování
Děkujeme Desiree Schumannové (Basilejská Univerzita) za její bystrou podporu při psaní tohoto rukopisu., Autoři jsou podporováni německou výzkumnou nadací (DFG) a JDRF. Chceme se omluvit za to, že jsme kvůli omezením prostoru neuvedli mnoho důležitých publikací.
9. Bernhard W. plicní povrchově aktivní látka: funkce a složení v kontextu vývoje a respirační fyziologie. Ann Anat. (2016) 208:146–50. doi: 10.1016 / j. aanat.2016.08.003
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
10. Wright JR., „Moudrost“ plicního povrchově aktivního činidla: vyvažování hostitelské obrany a funkcí snižujících povrchové napětí. Am J Physiol Lung Cell Mol Physiol. (2006) 291:L847–50. doi: 10.1152 / ajplung.00261.2006
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
11. Schicht M, Garreis F, Hartjen N, Beileke S, Jacobi C, Sahin a, et al. SFTA3-nový povrchově aktivní protein očního povrchu a jeho role v hojení ran rohovky a povrchové napětí slzného filmu. Sci Rep. (2018) 8:9791. doi: 10.,1038/s41598-018-28005-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Mittal RA, Hammel M, Schwarz J, Heschl KM, Bretschneider N, Flemmer AW, et al. SFTA2–a novel secretory peptide highly expressed in the lung–is modulated by lipopolysaccharide but not hyperoxia. PLoS ONE. (2012) 7:e40011. doi: 10.1371/journal.pone.0040011
PubMed Abstract | CrossRef Full Text | Google Scholar
15., Ramanathan R. povrchově aktivní léčba u předčasně narozených dětí se syndromem respirační tísně a u novorozenců s akutním RDS. J Perinatol. (2006) 26(Suppl. 1): S51–6; S63-4. doi: 10.1038/sj.jp.7211474
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
16. Byl JV, Zimmermann LJ. Co je nového v povrchově aktivní látce? Klinický pohled na nedávný vývoj v neonatologii a pediatrii. Europ J Pediatrics. (2007) 166:889–99. doi: 10.,1007/s00431-007-0501-4
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
17. Ainsworth SB, Beresford MW, Milligan DW, Shaw NJ, Matthews JN, Fenton AC, et al. Pumaktant a poraktant alfa pro léčbu syndromu respirační tísně u novorozenců narozených ve 25-29 týdnech těhotenství: randomizovaná studie. Lanceta. (2000) 355:1387–92. doi: 10.,1016/S0140-6736(00)02136-X
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Spragg RG, Lewis JF, Walmrath HD, Johannigman J, Bellingan G, Laterre PF, et al. Effect of recombinant surfactant protein C-based surfactant on the acute respiratory distress syndrome. N Engl J Med. (2004) 351:884–92. doi: 10.1056/NEJMoa033181
PubMed Abstract | CrossRef Full Text | Google Scholar
21., Findlay RD, Taeusch HW, Walther FJ. Surfactant replacement therapy for meconium aspiration syndrome. Pediatrics. (1996) 97:48–52.
PubMed Abstract | Google Scholar