Unikátní Chemii z Nejlehčích Prvků
chemie z druhé období prvek z každé skupiny (n = 2: Li, Be, B, C, N, O a F) se liší v mnoha důležitých ohledech od těžší členů, nebo kongenery ze skupiny. V důsledku toho jsou prvky třetího období (n = 3: Na, Mg, Al, Si, P, S A Cl) obecně reprezentativnější skupiny, do které patří., Anomální Chemie prvků druhého období vyplývá ze tří důležitých charakteristik: malé poloměry, energeticky nedostupné d orbitaly a tendence vytvářet pi (π) vazby s jinými atomy.
na rozdíl od chemie z druhého období, prvky, chemie, třetí-období prvků je více reprezentativní chemie příslušné skupiny.
Vzhledem k jejich malé poloměry, druhé období prvky mají elektronové afinity, které jsou méně negativní, než by předpovídal z obecné periodické trendy., Když je k tak malému atomu přidán elektron, zvýšené elektronové odpuzování mají tendenci destabilizovat aniont. Malé velikosti těchto prvků jim navíc brání v tvorbě sloučenin, ve kterých mají více než čtyři nejbližší sousedy. Tak BF3 tvoří pouze čtyři souřadnice, čtyřboká BF4− ion, vzhledem k tomu, že za stejných podmínek AlF3 tvoří šest-koordinovat, oktaedrická AlF63− ion. Vzhledem k menší atomové velikosti mají jednoduché binární iontové sloučeniny prvků druhého období také více kovalentního charakteru než odpovídající sloučeniny vytvořené z jejich těžších kongenerů., Velmi malé kationty odvozené z druhé období prvky mají vysoký náboj-poloměr poměr, a proto může polarizovat plné valence shell aniontů. Jako takové má vazba v takových sloučeninách významnou kovalentní složku, což dává sloučeninám vlastnosti, které se mohou výrazně lišit od vlastností očekávaných pro jednoduché iontové sloučeniny. Jako příklad, LiCl, který je částečně kovalentní charakter, je mnohem více rozpustný než NaCl v rozpouštědlech s relativně nízkou dielektrickou konstantou, jako je ethanol (ε = 25.3 versus 80.1 pro H2O).,
Protože d-orbitaly nejsou nikdy obsazené hlavní kvantová čísla menší než 3, valenční elektrony, druhé období prvky zabírají 2s a 2p orbitaly. Energie 3d orbitalů daleko převyšuje energii 2s a 2p orbitaly, takže jejich použití při lepení je energeticky neúnosné. V důsledku toho, elektronové konfigurace s více než čtyř elektronových párů kolem centrálního, druhé období prvkem jsou prostě není pozorován. Možná si vzpomenete, že role d orbitalů v lepení v sloučeninách hlavních skupin s koordinačními čísly 5 nebo vyššími zůstává poněkud kontroverzní., Ve skutečnosti byly publikovány teoretické popisy vazby v molekulách, jako je SF6, aniž by se zmínila účast d orbitalů na síře. Argumenty založené na d-orbital dostupnost a malá velikost centrální atom však předpokládají, že koordinační čísla vyšší než 4 jsou neobvyklé prvky druhého období, které je v souladu s experimentálními výsledky.,
jedním z nejdramatičtějších rozdílů mezi nejlehčími prvky hlavní skupiny a jejich těžšími kongenery je tendence prvků druhého období tvořit druhy, které obsahují více vazeb. Například, N je těsně nad P ve skupině 15: N2 obsahuje N≡N vazby, ale každý atom fosforu v tetraedrických P4 tvoří tři P–P dluhopisů. Tento rozdíl v chování odráží skutečnost, že ve stejné skupině periodické tabulky se relativní energie vazby π a vazby sigma (σ) liší. Například vazba C=C je přibližně o 80% silnější než vazba C–C., V kontrastu, Si=Si bond, s méně p-orbital překrývání valenčních orbitalů vázaných atomů, protože větší atomové velikosti, je pouze o 40% silnější, než Si–Si vazby. V důsledku toho jsou sloučeniny, které obsahují vícenásobné i jednotlivé vazby C až C, společné pro uhlík, ale sloučeniny, které obsahují pouze vazby sigma Si–Si, jsou energeticky příznivější pro křemík a další prvky třetího období.,
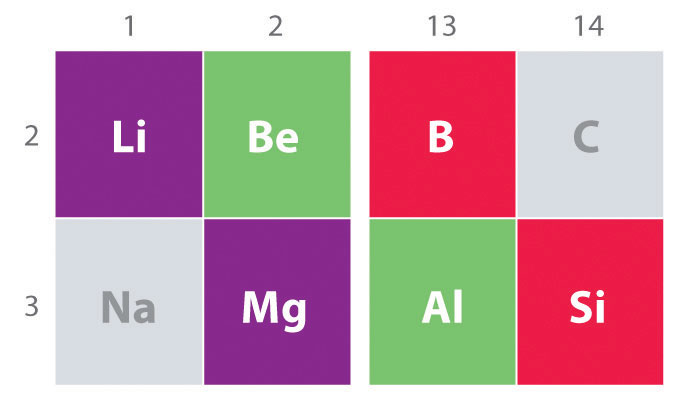
Další důležitý trend poznámka: v hlavní skupině chemie je chemická podobnost mezi nejlehčí prvek z jedné skupiny a prvku bezprostředně pod a vpravo od ní v další skupině, což je jev známý jako diagonální efekt (Obrázek \(\PageIndex{2}\)), Tam jsou, například, významné podobnosti mezi chemií Li a Mg a Al, a B a Si. BeCl2 i AlCl3 mají podstatný kovalentní charakter, takže jsou poněkud rozpustné v nepolárních organických rozpouštědlech., Naproti tomu, ačkoli Mg a Be jsou ve stejné skupině, MgCl2 se chová jako typický iontový halogenid kvůli nižší elektronegativitě a větší velikosti hořčíku.