Exclusivo Química dos Elementos mais Leves
A química do segundo período elemento de cada grupo (n = 2: Li, Be, B, C, N, O e F) difere em muitos aspectos importantes do que o mais pesado membros, ou congêneres, do grupo. Consequentemente, os elementos do terceiro período (n = 3: Na, Mg, Al, Si, P, S e Cl) são geralmente mais representativos do grupo a que pertencem., A química anômala dos elementos do segundo período resulta de três características importantes: pequenos raios, orbitais d energeticamente indisponíveis, e uma tendência a formar ligações pi (π) com outros átomos.
em contraste com a química dos elementos do segundo período, A química dos elementos do terceiro período é mais representativa da química do respectivo grupo.
devido aos seus pequenos raios, os elementos do segundo período têm afinidades elétricas menos negativas do que seria previsto a partir de tendências periódicas gerais., Quando um elétron é adicionado a um átomo tão pequeno, repulsões elétron–elétrons aumentadas tendem a desestabilizar o ânion. Além disso, os pequenos tamanhos desses elementos os impedem de formar compostos nos quais eles têm mais de quatro vizinhos mais próximos. Assim, BF3 forma apenas a quatro coordenadas, tetraédrica BF4-íon, enquanto que sob as mesmas condições AlF3 forma a seis coordenadas, octaédrica AlF63-íon. Devido ao tamanho atômico menor, compostos iônicos binários simples de elementos do segundo período também têm caráter mais covalente do que os compostos correspondentes formados a partir de seus congéneres mais pesados., Os cátions muito pequenos derivados de elementos de segundo período têm uma alta relação carga-raio e pode, portanto, polarizar a concha de Valência cheia de um anião. Como tal, a ligação em tais compostos tem um componente covalente significativo, dando aos compostos propriedades que podem diferir significativamente das esperadas para simples compostos iônicos. Como exemplo, LiCl, que é parcialmente covalente em caráter, é muito mais solúvel do que NaCl em solventes com uma constante dielétrica relativamente baixa, como o etanol (ε = 25,3 versus 80,1 para H2O).,
porque orbitais d nunca são ocupados por números quânticos principais inferiores a 3, os elétrons de valência de elementos de segundo período ocupam orbitais 2s e 2p apenas. A energia dos orbitais 3d excede em muito a energia dos orbitais 2s e 2p, então usá-los na ligação é energeticamente proibitivo. Consequentemente, configurações de elétrons com mais de quatro pares de elétrons em torno de um elemento central de segundo período simplesmente não são observadas. Você pode lembrar que o papel dos orbitais d na ligação em compostos de grupo principal com números de coordenação de 5 ou mais permanece um pouco controverso., De fato, descrições teóricas da ligação em moléculas como SF6 foram publicadas sem mencionar a participação de orbitais d em enxofre. Argumentos baseados na disponibilidade d-orbital e no pequeno tamanho do átomo central, no entanto, predizem que números de coordenação maiores que 4 são incomuns para os elementos do segundo período, que está de acordo com os resultados experimentais.,uma das diferenças mais dramáticas entre os elementos mais leves do grupo e seus congéneres mais pesados é a tendência dos elementos do segundo período para formar espécies que contêm múltiplas ligações. Por exemplo, N é um pouco acima de P no grupo 15: N2 contém uma ligação n≡n, Mas cada átomo de fósforo no tetraédrico P4 forma três ligações P-P. Esta diferença de comportamento reflete o fato de que dentro do mesmo grupo da tabela periódica, as energias relativas da ligação π e da ligação sigma (σ) diferem. Uma ligação C=C, por exemplo, é aproximadamente 80% mais forte que uma ligação C–C., Em contraste, uma ligação Si = Si, com menor sobreposição orbital-p entre os orbitais de Valência dos átomos ligados por causa do tamanho atômico maior, é apenas cerca de 40% mais forte do que uma ligação Si–Si. Consequentemente, compostos que contêm ligações múltiplas e únicas C A C são comuns para o carbono, mas compostos que contêm apenas ligações sigma Si–Si são mais energeticamente favoráveis para o silício e os outros elementos do terceiro período.,
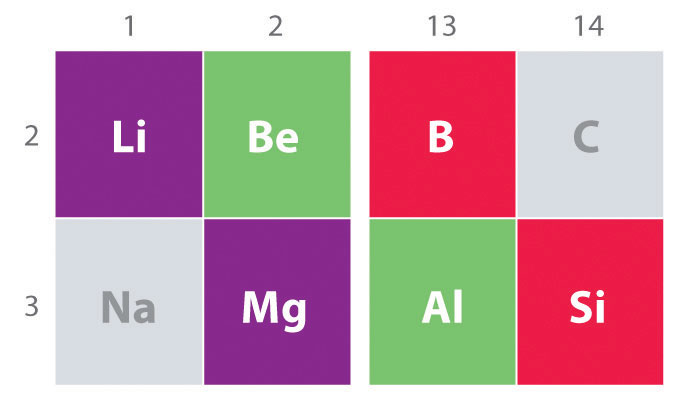
Outra tendência importante a observação no grupo principal química é a semelhança química entre o elemento mais leve de um grupo e o elemento imediatamente abaixo e à direita do que no grupo seguinte, um fenômeno conhecido como efeito diagonal (Figura \(\PageIndex{2}\)), Existem, por exemplo, significativas semelhanças entre a composição química da Li e Mg, o Ser e Al, e B e Si. Ambos BeCl2 e AlCl3 têm um caráter covalente substancial, então eles são um pouco solúveis em solventes orgânicos não-solares., Em contraste, embora Mg e Be estejam no mesmo grupo, MgCl2 se comporta como um haleto iônico típico devido à menor eletronegatividade e tamanho maior de magnésio.